

| ||
| H+ |
| nmol×1 |
| 4 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
A、可以收集到氯气
| ||
| B、反应后溶液中的Cl-数目为2aNA/87 | ||
C、NA可表示为
| ||
| D、反应后溶液中的H+数目为(bc-2d) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝热反应属于吸热反应 | ||||
| B、“H-CI→H+C1“过程中放出热量 | ||||
| C、干冰升华过程放出热量 | ||||
D、 反应“C+H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
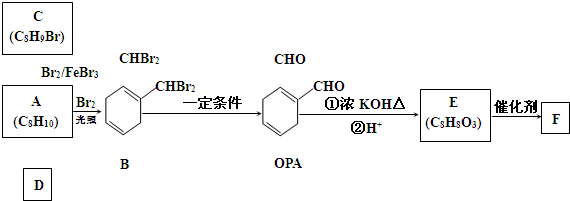

| 浓硫酸 |
| 170℃ |
| Br2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
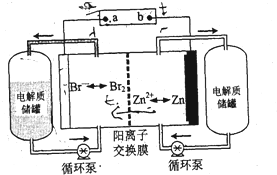 锌溴液流电池是一种新型电化学储能装置(如图所示)电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环,下列说法正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示)电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环,下列说法正确的是( )| A、充电时电极b连接电源的正极 |
| B、放电时正极的电极反应式为Zn-2e-=Zn2+ |
| C、阳离子交换膜可阻止Br2与Zn直接发生反应 |
| D、充电时左侧电解质储罐中的离子总浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | A | ||
| Y | C | B |
| A、原子半径大小:Y>C>X>A |
| B、Y和B形成的化合物中Y和B的原子个数比为2:3 |
| C、X、C、A中最高价氧化物对应的水化物的酸性最强的是A |
| D、A、B均为非金属元素,所以两者的氢化物相遇不发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
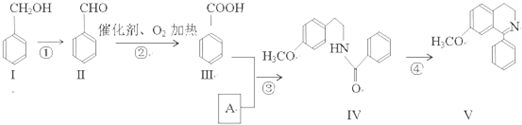
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com