
【题目】给下列有机物命名及写结构简式。
(1)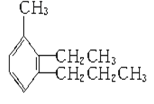 ____________________________________
____________________________________
(2) ____________________________________
____________________________________
(3)间甲基苯乙烯:_________________________________
【答案】3-甲基-2-乙基正丙苯 2-甲基-1,3-丁二烯 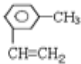
【解析】
(1)从正丙基开始编号,在2号位置上有乙基,3号位置上有甲基,据此分析解答
(2)烯烃命名时,选含碳碳双键的最长的碳链为主链,故此烯烃的主链上有4个碳原子,含有2个碳碳双键,从离碳碳双键最近的一端给主链上的碳原子进行编号,据此分析解答;
(3)间甲基苯乙烯,母体为苯环,苯环上乙烯基、甲基处于间位,据此书写结构简式。
(1)从正丙基开始编号,在2号位置上有乙基,3号位置上有甲基,该有机物的名称为3-甲基-2-乙基正丙苯,故答案为:3-甲基-2-乙基正丙苯;
(2)烯烃命名时,选含碳碳双键的最长的碳链为主链,故此烯烃的主链上有4个碳原子,含有2个碳碳双键,故母名为1,3-丁二烯,从离官能团近的一端给主链上的碳原子进行编号,在2号碳原子上有一个甲基,故名称为2-甲基-1,3-丁二烯,故答案为:2-甲基-1,3-丁二烯;
(3)间甲基苯乙烯,母体为苯环,苯环上乙烯基、甲基处于间位,该有机物的结构简式为: ,故答案为:
,故答案为: 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】室温下,下来事实不能说明NH3·H2O为弱电解质的是
A. 0.1 mol·L-1NH3·H2O的pH小于13
B. 0.1 mol·L-1 NH4Cl溶液的pH小于7
C. 相同条件下,浓度均为0.1 mol·L-1 NaOH溶液和氨水,氨水的导电能力弱
D. 0.1 mol·L-1NH3·H2O能使无色酚酞试液变红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)亚铁氰化钾是食盐中常用的抗结剂,其化学式为K4[Fe(CN)6]。
①CN-的电子式是__________;1 mol该配离子中含σ键数目为________。
②该配合物中存在的作用力类型有_________(填字母)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力
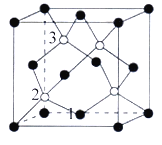
(2)磷化硼(BP)是一种超硬耐磨涂层材料,如图为其晶胞,晶胞边长为a nm。则硼原子与磷原子最近的距离为__________。 用M g·mol-1表示磷化硼的摩尔质量,NA表示阿伏加德罗常数的值,则磷化硼晶体的密度为__________g·cm-3。
(3)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中3原子1的坐标为(1/2,1/2,0),则原子3的坐标分别为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述不正确的是 ( )
A.电解饱和食盐水,阳极产生22.4 L气体时,电路中通过的电子数目为2NA
B.a g某气体含分子数为b,c g该气体在标准状况下的体积为![]() L
L
C.含有氢原子数为0.4NA的CH3OH分子中含有的共价键数目为0.5NA
D.常温下,1.0 L pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4-CO2催化重整不仅可以得到合成气CO和H2,还对温室气体的减排具有重要意义。
已知:C(s)+2H2(g)=CH4(g) △H1 K1 C(s)+O2(g) =CO2(g) △H2 K2 ;C(s)+![]() O2(g) =CO(g) △H3 K3;CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g) △H K(其中△H为焓变,K为平衡常数)下列说法正确的是
O2(g) =CO(g) △H3 K3;CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g) △H K(其中△H为焓变,K为平衡常数)下列说法正确的是
A. △H=2△H3-2△H2-△H1
B. K=2K3-K2-K1
C. 若平衡时c(CH4):c(CO2):c(CO):c(H2)=1:1:1:1,则K一定等于1(mol/L)2
D. 减小压强可增大CH4(g)和CO2(g)的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定某有机物A的结构,做如下实验:
①将2.3 g该有机物完全燃烧,生成0.1 mol CO2和2.7 g水;
②用质谱仪测定其相对分子质量,得如图一所示的质谱图;
③用核磁共振仪处理该化合物,得到如图二所示图谱,图中三个峰的面积之比是1∶2∶3。
试回答下列问题:
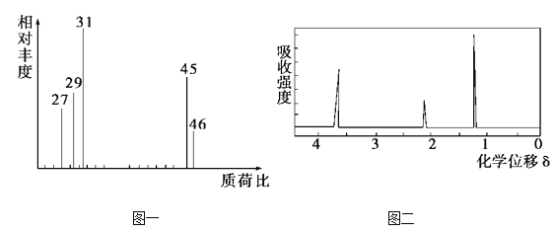
(1)有机物A的相对分子质量是_______
(2)有机物A的实验式是________
(3)能否根据A的实验式确实A的分子式______
(4)写出该物质的结构简式:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )

①装置甲可防止铁钉生锈
②装置乙可除去乙烯中混有的乙炔
③装置丙可验证HCl气体在水中的溶解性
④装置丁可用于实验室制取乙酸乙酯
⑤装置戊可用于收集H2、CO2、Cl2、HCl、NO2等气体
A.①⑤B.②④C.③④D.③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是
A. Na2CO3+2HCl=Na2CO3+CO2↑+H2O B. H2O+CO2=H2CO3
C. 2Na2O2+2H2O=4NaOH+O2↑ D. 2Al(OH)3![]() Al2O3+3H2O
Al2O3+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g)![]() NH2COONH4(s) △H1
NH2COONH4(s) △H1
反应Ⅱ:NH2COONH4(s)![]() CO(NH2)2(s)+H2O(g) △H2= +72.49kJ/mol
CO(NH2)2(s)+H2O(g) △H2= +72.49kJ/mol
总反应:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) △H3= -86.98kJ/mol
CO(NH2)2(s)+H2O(g) △H3= -86.98kJ/mol
①反应Ⅰ的△H1=______________。
②一定温度下,在体积固定的密闭容器中按 n(NH3):n(CO2)=2:1 进行反应Ⅰ,下列能说明反应Ⅰ达到了平衡状态的是_______(填序号)。
A 容器内气体总压强不再变化
B NH3与CO2的转化率相等
C 容器内混合气体的密度不再变化
(2)在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
①该反应的化学平衡常数表达式为K=___________。
②该反应为____________(填“吸热”或“放热”)反应。
③某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________℃。
④在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2 mol·L-1,c(H2)为1.5 mol·L-1,c(CO)为1 mol·L-1,c(H2O)为3 mol·L-1,此时反应向________(填“正向”或“逆向”)进行。
(3)工业上从废铅蓄电池废液回收铅的过程中,常用纯碱溶液与处理后的铅膏(主要含PbSO4)发生反应:PbSO4(s)+CO32-(aq)![]() PbCO3(s)+SO42-(aq)。已知溶度积常数:Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,则该反应的化学平衡常数K =____。
PbCO3(s)+SO42-(aq)。已知溶度积常数:Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,则该反应的化学平衡常数K =____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com