
【题目】下列叙述正确的是( )

①装置甲可防止铁钉生锈
②装置乙可除去乙烯中混有的乙炔
③装置丙可验证HCl气体在水中的溶解性
④装置丁可用于实验室制取乙酸乙酯
⑤装置戊可用于收集H2、CO2、Cl2、HCl、NO2等气体
A.①⑤B.②④C.③④D.③⑤
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
【题目】为研究某溶液中溶质R的分解速率的影响因素,分别用三份不同初始浓度的R溶液在不同温度下进行实验,c(R)随时间变化如图。下列说法不正确的是( )
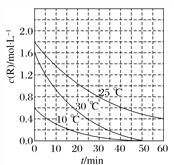
A. 25 ℃时,在0~30 min内,R的分解平均速度为0.033 mol·L-1·min-1
B. 对比30 ℃和10 ℃曲线,在50 min时,R的分解百分率相等
C. 对比30 ℃和25 ℃曲线,在0~50 min内,能说明R的分解平均速度随温度升高而增大
D. 对比30 ℃和10 ℃曲线,在同一时刻,能说明R的分解速率随温度升高而增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物含量显得尤为重要。
Ⅰ.氮氧化物研究
(1)一定条件下,将2molNO与2molO2置于恒容密闭容器中发生反应2NO(g)+O2(g)![]() 2NO2(g),下列各项能说明反应达到平衡状态的是____________。
2NO2(g),下列各项能说明反应达到平衡状态的是____________。
a.体系压强保持不变 b.混合气体密度保持不变
c.NO和O2的物质的量之比保持不变 d.每消耗2molNO同时生成2 molNO2
(2)汽车内燃机工作时会引起N2和O2的反应:N2+ O2![]() 2NO,是导致汽车尾气中含有NO的原因之一。在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应N2(g)+ O2(g)
2NO,是导致汽车尾气中含有NO的原因之一。在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应N2(g)+ O2(g)![]() 2NO(g)的△H____0(填“>”或“<”)。
2NO(g)的△H____0(填“>”或“<”)。

(3)NOx是汽车尾气中的主要污染物之一。汽车发动机工作时会引发N2和O2反应,
其能量变化如图所示:
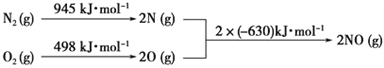
写出该反应的热化学方程式:________________________________。
Ⅱ.二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是坏境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(s)+O2(g)![]() 2SO3(g),某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如下图所示。根据图示回答下列问题:
2SO3(g),某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如下图所示。根据图示回答下列问题:
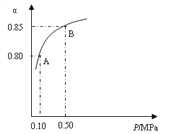
①将2.0 molSO2和1.0molO2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于__________。
②平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为__________(阿伏加德罗常数的值用NA表示),放出的热量为___________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】给下列有机物命名及写结构简式。
(1)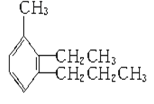 ____________________________________
____________________________________
(2) ____________________________________
____________________________________
(3)间甲基苯乙烯:_________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)金刚烷的结构如图1所示,它可看作是由四个等同的六元环组成的空间构型。
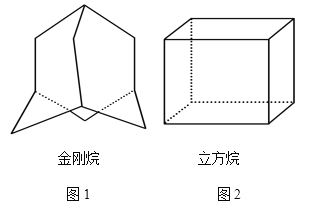
①金刚烷的分子式为________;
②根据中学学过的同分异构体判断规则,判断由溴原子取代分子中的氢原子形成的一溴代物有_____种。
(2)“立方烷”是一种新合成的烃,其分子为正方体结构,其碳架结构如图2所示。
①立方烷的分子式为______________________;
②该立方烷的二氯代物具有同分异构体的数目是_____________;
③将a g立方烷溶于b mL苯中,然后通入c L乙炔(标准状况下),所得混合物中碳的百分含量为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、某温度时,在一个 10L 的恒容容器中,X、Y、Z 均为气体,三种物质的物 质的量随时间的变化曲线如图所示.根据图中数据填空:
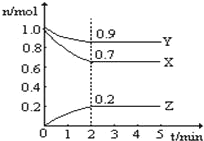
(1)该反应的化学方程式为______;
(2)反应开始至 2min,以气体 Z 表示的平均反应速率为______;
(3)平衡时容器内混合气体密度比起始时______(填“变大”,“变小”或“不变” 下同),混合气体的平均相对分子质量比起始时__________;
(4)将 a mol X 与 b mol Y 的混合气体发生上述反应,反应到某时刻各物质的量恰好满足: n(X)=n(Y)=2n(Z),则原混合气体中 a:b=______。
Ⅱ、在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强,②混合 气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜 色,⑥各反应物或生成物的反应速率之比等于化学计量数之比
(1)一定能证明 2SO2(g)+O2(g)![]() 2SO3(g)达到平衡状态的是_____(填序号,下同)。
2SO3(g)达到平衡状态的是_____(填序号,下同)。
(2)一定能证明 I2(g)+H2(g)![]() 2HI(g)达到平衡状态的是 ______。
2HI(g)达到平衡状态的是 ______。
(3)一定能证明 A(s)+2B(g)![]() C(g)+D(g)达到平衡状态的是______。(B C D 均无色)
C(g)+D(g)达到平衡状态的是______。(B C D 均无色)
III 、某化学反应 2A![]() B+D 在四种条件下进行,B、D 起始浓度为 0,反应物 A 的浓度(mol/L)随反应时间(min)的变化情况如表:
B+D 在四种条件下进行,B、D 起始浓度为 0,反应物 A 的浓度(mol/L)随反应时间(min)的变化情况如表:
实验序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800 | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800 | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
4 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
比较实验 4 和实验 1 可推测该正反应是_____反应(填“吸热”或“放热”)。 理由_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如何降低大气中CO2的含量及有效利用CO2,目前已引起各国普遍重视。
(1)工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1molCO2和3molH2,在500℃下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。实验测得CO2(g)和CH3OH(g)的浓度随时间变化如图1所示。
CH3OH(g)+H2O(g)。实验测得CO2(g)和CH3OH(g)的浓度随时间变化如图1所示。

①从反应开始到平衡,氢气的平均反应速率v(H2)=__;
②图2是改变温度时H2的化学反应速率随时间变化的示意图,则该反应的正反应是__热(填“吸”或“放”)反应。
③该反应的平衡常数K为__(保留两位小数)。若提高温度到800℃进行,达平衡时,K值__(填“增大”、“减小”或“不变”),
④500℃达平衡时,CH3OH的体积分数ω为__。
Ⅱ.(2)工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3),其三步反应如下:
①2H2(g)+CO(g)![]() CH3OH(g) △H=-90.8kJmol-1
CH3OH(g) △H=-90.8kJmol-1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H=-23.5kJmol-1
CH3OCH3(g)+H2O(g) △H=-23.5kJmol-1
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41.3kJmol-1
CO2(g)+H2(g) △H=-41.3kJmol-1
总合成反应的热化学方程式为__。
(3)一定条件下的密闭容器中,上述总反应达到平衡时,要提高CO的转化率,可以采取的措施是__(填字母代号)。
A.高温高压
B.加入催化剂
C.减少CO2的浓度
D.增加CO的浓度
E.分离出二甲醚
(4)已知反应②2CH3OH(g)![]() CH3OCH3(g)+H2O(g)在某温度下的平衡常数K=400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数K=400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
c/molL-1 | 0.44 | 0.60 | 0.60 |
此时,v(正)__v(逆)(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
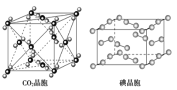
【题目】有关晶体的结构如图所示,下列说法中不正确的是( )
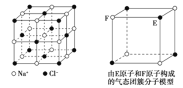
A.在NaCl晶体中,距Na+最近的Cl-形成正八面体
B.该气态团簇分子的分子式为E4F4或F4E4
C.在CO2 晶体中,一个CO2 分子周围有4个CO2 分子紧邻
D.在碘晶体中,碘分子的排列有两种不同的方向
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com