
【题目】按要求回答下列问题:
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g)![]() NH2COONH4(s) △H1
NH2COONH4(s) △H1
反应Ⅱ:NH2COONH4(s)![]() CO(NH2)2(s)+H2O(g) △H2= +72.49kJ/mol
CO(NH2)2(s)+H2O(g) △H2= +72.49kJ/mol
总反应:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) △H3= -86.98kJ/mol
CO(NH2)2(s)+H2O(g) △H3= -86.98kJ/mol
①反应Ⅰ的△H1=______________。
②一定温度下,在体积固定的密闭容器中按 n(NH3):n(CO2)=2:1 进行反应Ⅰ,下列能说明反应Ⅰ达到了平衡状态的是_______(填序号)。
A 容器内气体总压强不再变化
B NH3与CO2的转化率相等
C 容器内混合气体的密度不再变化
(2)在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
①该反应的化学平衡常数表达式为K=___________。
②该反应为____________(填“吸热”或“放热”)反应。
③某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________℃。
④在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2 mol·L-1,c(H2)为1.5 mol·L-1,c(CO)为1 mol·L-1,c(H2O)为3 mol·L-1,此时反应向________(填“正向”或“逆向”)进行。
(3)工业上从废铅蓄电池废液回收铅的过程中,常用纯碱溶液与处理后的铅膏(主要含PbSO4)发生反应:PbSO4(s)+CO32-(aq)![]() PbCO3(s)+SO42-(aq)。已知溶度积常数:Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,则该反应的化学平衡常数K =____。
PbCO3(s)+SO42-(aq)。已知溶度积常数:Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,则该反应的化学平衡常数K =____。
【答案】-159.47 kJ/mol AC c(CO)c(H2O)/c(CO2)c(H2) 吸热 830 逆向 2.2×105或2.16×105
【解析】
(1) ①根据盖斯定律计算;②根据反应达到化学平衡状态的特征进行分析判断;
(2)①根据平衡常数表达式书写;②根据影响平衡常数的因素进行分析;③根据浓度商和平衡常数的关系判断反应进行的方向;
(3)根据溶度积和平衡常数表达式进行计算。
(1)①反应Ⅰ:2NH3(g)+CO2(g)![]() NH2COONH4(s)△H1
NH2COONH4(s)△H1
反应Ⅱ:NH2COONH4(s)![]() CO(NH2)2(s)+H2O(g)△H2= +72.49kJ/mol
CO(NH2)2(s)+H2O(g)△H2= +72.49kJ/mol
总反应:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)△H3= -86.98kJ/mol
CO(NH2)2(s)+H2O(g)△H3= -86.98kJ/mol
根据盖斯定律计算:△H1=△H3-△H2=-86.98kJ/mol-72.49kJ/mol=-159.47 kJ/mol,故答案:-159.47 kJ/mol;
②A.根据2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)反应可知,反应前后气体体积减小,容器内气体总压强不再变化说明反应达到平衡状态,故A正确;
CO(NH2)2(s)+H2O(g)反应可知,反应前后气体体积减小,容器内气体总压强不再变化说明反应达到平衡状态,故A正确;
B.转化率与起始量和变化量有关,所以NH3与CO2的转化率相等,不能说明反应达到平衡状态,故B错误;
C.根据2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)反应可知, 反应前后气体质量变化,气体体积不变,容器内混合气体的密度不再变化说明反应达到平衡状态,故C正确;
CO(NH2)2(s)+H2O(g)反应可知, 反应前后气体质量变化,气体体积不变,容器内混合气体的密度不再变化说明反应达到平衡状态,故C正确;
故答案为:AC;
(2) ①因平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,所以K=![]() ,故答案为:K=
,故答案为:K=![]() ;
;
②化学平衡常数的大小只与温度有关,升高温度平衡向吸热的方向移动,由表可知:升高温度,化学平衡常数增大,说明化学平衡正向移动,因此正反应方向吸热反应,故答案为:吸热;
③某温度下,因为平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),所以![]() =1,根据表格可知:温度为830℃时K=1,所以此时的温度为830℃,故答案:830;
=1,根据表格可知:温度为830℃时K=1,所以此时的温度为830℃,故答案:830;
④已知800 ℃时,K=0.9。某一时刻测得容器内各物质的浓度分别为c(CO2)为2 mol·L-1,c(H2)为1.5 mol·L-1,c(CO)为1 mol·L-1,c(H2O)为3 mol·L-1,根据Qc=![]() =
=![]() =1>0.9,此时反应向逆反应方向进行,故答案:逆向;
=1>0.9,此时反应向逆反应方向进行,故答案:逆向;
(3)Ksp(PbCO3)= 7.4×10-14,Ksp (PbSO4)= 1.6×10-8,在水溶液中进行PbSO4(s)+![]() PbCO3(s)+SO42-(aq)反应,反应的平衡常数K=
PbCO3(s)+SO42-(aq)反应,反应的平衡常数K=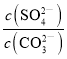 =
=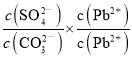 =
=![]() =
=![]() =2.16×105或2.2×105,故答案:2.2×105或2.16×105。
=2.16×105或2.2×105,故答案:2.2×105或2.16×105。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】给下列有机物命名及写结构简式。
(1)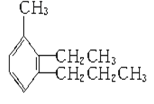 ____________________________________
____________________________________
(2) ____________________________________
____________________________________
(3)间甲基苯乙烯:_________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如何降低大气中CO2的含量及有效利用CO2,目前已引起各国普遍重视。
(1)工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1molCO2和3molH2,在500℃下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。实验测得CO2(g)和CH3OH(g)的浓度随时间变化如图1所示。
CH3OH(g)+H2O(g)。实验测得CO2(g)和CH3OH(g)的浓度随时间变化如图1所示。

①从反应开始到平衡,氢气的平均反应速率v(H2)=__;
②图2是改变温度时H2的化学反应速率随时间变化的示意图,则该反应的正反应是__热(填“吸”或“放”)反应。
③该反应的平衡常数K为__(保留两位小数)。若提高温度到800℃进行,达平衡时,K值__(填“增大”、“减小”或“不变”),
④500℃达平衡时,CH3OH的体积分数ω为__。
Ⅱ.(2)工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3),其三步反应如下:
①2H2(g)+CO(g)![]() CH3OH(g) △H=-90.8kJmol-1
CH3OH(g) △H=-90.8kJmol-1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H=-23.5kJmol-1
CH3OCH3(g)+H2O(g) △H=-23.5kJmol-1
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41.3kJmol-1
CO2(g)+H2(g) △H=-41.3kJmol-1
总合成反应的热化学方程式为__。
(3)一定条件下的密闭容器中,上述总反应达到平衡时,要提高CO的转化率,可以采取的措施是__(填字母代号)。
A.高温高压
B.加入催化剂
C.减少CO2的浓度
D.增加CO的浓度
E.分离出二甲醚
(4)已知反应②2CH3OH(g)![]() CH3OCH3(g)+H2O(g)在某温度下的平衡常数K=400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数K=400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
c/molL-1 | 0.44 | 0.60 | 0.60 |
此时,v(正)__v(逆)(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(![]() )。下列说法不正确的是
)。下列说法不正确的是
①![]()
![]()
②![]()
![]()
③![]()
![]()
④![]()
![]()
A. 反应①、②为反应③提供原料气
B. 反应③也是![]() 资源化利用的方法之一
资源化利用的方法之一
C. 反应![]() 的
的![]()
D. 反应![]() 的
的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示。若Y原子的最内层电子数是最外层电子数的1/3,下列说法中正确的是

A.Y、Z元素的最高正价均为+6价
B.X、Y元素形成的化合物均为酸性氧化物
C.最高价氧化物对应水化物的酸性:W>Z
D.W单质能与氢氧化钠溶液反应,生成一种具有漂白性的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“位置”、“结构”和“性质”是我们学习元素周期律的重要思路。
(1)我们可以根据原子结构示意图来推测元素在周期表中的位置,以下为X元素的原子结构示意图(未画全):
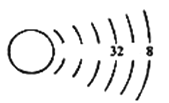
请写出X元素在周期表中的位置_____________________。
(2)我们也可以根据物质性质推测该元素在元素周期表中的位置,如Y元素最高价氧化物既可以溶于浓盐酸,也可以溶于NaOH溶液;其最高价氧化物对应的水化物既可以与酸反应,也可以与碱反应;1mol该元素最高价氧化物对应的水化物在与盐酸反应时,最多能消耗4molHCl。请写出Y元素在周期表中的位置_____________________。
(3)反过来,知道了元素的位置关系,我们可以推测元素性质或者元素对应的单质及化合物的性质。四种短周期元素在周期表中的位置如下图所示,其中只有M为金属元素。则Y和Z原子半径更大的是____(填元素符号或化学式,下同),Y和X最高价氧化物对应水化物的酸性更弱的是______。
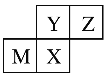
查看答案和解析>>
科目:高中化学 来源: 题型:
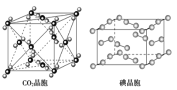
【题目】有关晶体的结构如图所示,下列说法中不正确的是( )
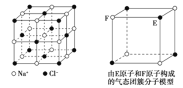
A.在NaCl晶体中,距Na+最近的Cl-形成正八面体
B.该气态团簇分子的分子式为E4F4或F4E4
C.在CO2 晶体中,一个CO2 分子周围有4个CO2 分子紧邻
D.在碘晶体中,碘分子的排列有两种不同的方向
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学涉及多种常数,下列说法正确的是( )
A.两种物质反应,不管怎样书写化学方程式,平衡常数不变
B.某温度下,2L密闭容器中加入4mol A和2mol B发生反应:
3A(g)+2B(g)![]() 4C(s)+2D(g)。平衡时测得n(C)=1.6mol,反应的化学平衡常数表达式为K=
4C(s)+2D(g)。平衡时测得n(C)=1.6mol,反应的化学平衡常数表达式为K=![]()
C.温度一定时,当溶液中c(Ag+ )· c(Cl-)等于Ksp值时,此溶液为AgCl的饱和溶液
D.难溶电解质AB2饱和溶液中,c(A2+ )=x mol·L﹣1,c(B—)=y mol·L﹣1,则Ksp值为4xy2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是生命的源泉、工业的血液、城市的命脉。要保护好河流,河水是重要的饮用水源,污染物通过饮用水可直接毒害人体。也可通过食物链和灌溉农田间接危及健康。请回答下列问题:
(1)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为________,由水电离出的c(OH-)=_______mol/L
(2)纯水在100℃时,pH=6,该温度下1mol/L的NaOH溶液中,由水电离出的 c(OH-)=_______mol/L。
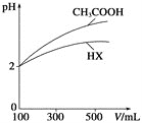
(3)体积均为100mL、pH均为2的CH3COOH溶液与一元酸HX溶液,加水稀释过程中pH与溶液体积的关系如下图所示,则HX的电离平衡常数___(填”大于””小于”或“等于”)CH3COOH的电离平衡常数。
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K==1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.610-11 |
①25℃时,有等浓度的NaCN溶液、Na2CO3液和CH3COONa溶液,三种溶液的pH由大到小的顺序为___。
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为______
(5)25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中 c(CH3COO-)-c(Na+)=_____(填精确值)mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com