
【题目】水是生命的源泉、工业的血液、城市的命脉。要保护好河流,河水是重要的饮用水源,污染物通过饮用水可直接毒害人体。也可通过食物链和灌溉农田间接危及健康。请回答下列问题:
(1)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为________,由水电离出的c(OH-)=_______mol/L
(2)纯水在100℃时,pH=6,该温度下1mol/L的NaOH溶液中,由水电离出的 c(OH-)=_______mol/L。
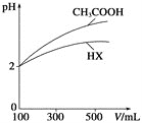
(3)体积均为100mL、pH均为2的CH3COOH溶液与一元酸HX溶液,加水稀释过程中pH与溶液体积的关系如下图所示,则HX的电离平衡常数___(填”大于””小于”或“等于”)CH3COOH的电离平衡常数。
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K==1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.610-11 |
①25℃时,有等浓度的NaCN溶液、Na2CO3液和CH3COONa溶液,三种溶液的pH由大到小的顺序为___。
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为______
(5)25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中 c(CH3COO-)-c(Na+)=_____(填精确值)mol/L
【答案】CO32—+H2O![]() HCO3—+OH-、HCO3—+H2O
HCO3—+OH-、HCO3—+H2O![]() H2CO3+OH- 10-3 10-12 小于 pH(Na2CO3溶液)>pH(NaCN溶液)>pH(CH3COONa溶液) NaCN+H2O+CO2=HCN+NaHCO3 9.9×10-7
H2CO3+OH- 10-3 10-12 小于 pH(Na2CO3溶液)>pH(NaCN溶液)>pH(CH3COONa溶液) NaCN+H2O+CO2=HCN+NaHCO3 9.9×10-7
【解析】
(1)碳酸钠溶液中因碳酸根离子水解导致溶液显碱性,盐溶液中盐的水解促进水的电离;
(2)纯水在100℃时,pH=6,Kw=10-12,据此计算水电离出的氢氧根离子浓度;
(3)据图分析,加水稀释的过程中,HX的pH变化比较慢,说明HX的酸性比醋酸弱;
(4)①根据酸的电离常数进行分析判断,电离常数越大,对应盐的水解程度越小,溶液的pH越小;
②电离平衡常数越大,酸的酸性越强,根据表中数据可知酸性:H2CO3>HCN>HCO3-,向NaCN溶液中通入少量CO2,反应生成HCN和碳酸氢钠,据此写出反应的化学方程式;
(5)溶液中的电荷守恒来分析,c(CH3COO-)+c(OH-)=c(Na+)+c(H+),因此c(CH3COO-)-c(Na+)= c(H+)-c(OH-)。
(1)碳酸钠溶液中因碳酸根离子水解导致溶液显碱性,碳酸根水解的离子方程式为CO32—+H2O![]() HCO3—+OH-、HCO3—+H2O
HCO3—+OH-、HCO3—+H2O![]() H2CO3+OH-,其pH=11,则c(OH-)=0.001mol/L,全部由水电离产生,故答案为:CO32—+H2O
H2CO3+OH-,其pH=11,则c(OH-)=0.001mol/L,全部由水电离产生,故答案为:CO32—+H2O![]() HCO3—+OH-、HCO3—+H2O
HCO3—+OH-、HCO3—+H2O![]() H2CO3+OH-;0.001;
H2CO3+OH-;0.001;
(2)纯水在100℃时,pH=6,Kw=10-12,该温度下1mol![]() L-1的NaOH溶液中,由水电离出的c(OH-)=c(H+)=10-12mol/L,故答案为:10-12;
L-1的NaOH溶液中,由水电离出的c(OH-)=c(H+)=10-12mol/L,故答案为:10-12;
(3)据图分析,加水稀释的过程中,HX的pH变化比较慢,说明HX的酸性比醋酸弱,HX的电离平衡常数比醋酸小,故答案为:小于;
(4)①根据图表数据分析,电离常数:醋酸>HCN>碳酸氢根离子,所以等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液水解程度为:Na2CO3溶液>NaCN溶液>CH3COONa溶液,故溶液的pH为:Na2CO3溶液>NaCN溶液>CH3COONa溶液,故答案为:pH(Na2CO3溶液)>pH(NaCN溶液)>pH(CH3COONa溶液);
②根据电离平衡常数大小可知酸性:H2CO3>HCN>HCO3-,向NaCN溶液中通入少量CO2,反应生成HCN和碳酸氢钠,不能生成二氧化碳,反应的化学方程式为:NaCN+H2O+CO2=HCN+NaHCO3,故答案为:NaCN+H2O+CO2=HCN+NaHCO3;
(5)25℃时,CH3COOH和CH3COONa的混合溶液,若测得混合液的pH=6,即c(H+)=10-6
根据电荷守恒可知:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),因此c(CH3COO-)-c(Na+)= c(H+)-c(OH-)=10-6mol/L-10-8mol/L=9.9×10-7mol/L,故答案为:9.9×10-7。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g)![]() NH2COONH4(s) △H1
NH2COONH4(s) △H1
反应Ⅱ:NH2COONH4(s)![]() CO(NH2)2(s)+H2O(g) △H2= +72.49kJ/mol
CO(NH2)2(s)+H2O(g) △H2= +72.49kJ/mol
总反应:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) △H3= -86.98kJ/mol
CO(NH2)2(s)+H2O(g) △H3= -86.98kJ/mol
①反应Ⅰ的△H1=______________。
②一定温度下,在体积固定的密闭容器中按 n(NH3):n(CO2)=2:1 进行反应Ⅰ,下列能说明反应Ⅰ达到了平衡状态的是_______(填序号)。
A 容器内气体总压强不再变化
B NH3与CO2的转化率相等
C 容器内混合气体的密度不再变化
(2)在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
①该反应的化学平衡常数表达式为K=___________。
②该反应为____________(填“吸热”或“放热”)反应。
③某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________℃。
④在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2 mol·L-1,c(H2)为1.5 mol·L-1,c(CO)为1 mol·L-1,c(H2O)为3 mol·L-1,此时反应向________(填“正向”或“逆向”)进行。
(3)工业上从废铅蓄电池废液回收铅的过程中,常用纯碱溶液与处理后的铅膏(主要含PbSO4)发生反应:PbSO4(s)+CO32-(aq)![]() PbCO3(s)+SO42-(aq)。已知溶度积常数:Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,则该反应的化学平衡常数K =____。
PbCO3(s)+SO42-(aq)。已知溶度积常数:Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,则该反应的化学平衡常数K =____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
A.酸碱中和滴定时,滴定管和锥形瓶在使用前均需用待装液润洗
B.清洗碘升华实验所用试管,先用稀盐酸清洗,再用水清洗
C.实验室从海带提取单质碘的方法是:取样![]() 灼烧
灼烧![]() 溶解
溶解![]() 过滤
过滤![]() 萃取
萃取
D.配制![]() 溶液时未恢复至室温就转移并定容,所得溶液浓度偏小
溶液时未恢复至室温就转移并定容,所得溶液浓度偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,有关该有机物的叙述不正确的是
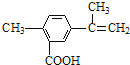
A. 在一定条件下,能发生取代、氧化和加聚反应
B. 该物质分子中最多可以有11个碳原子在同一平面上
C. 1 mol该物质最多可与5 mol H2发生加成反应
D. 1 mol该物质完全氧化最多可消耗13 mol氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N、Cu及其相关化合物用途非常广泛。回答下列问题:
(1)基态铜原子的价电子排布式为__________________。
(2)铜与钾处于同周期且最外层电子数相同,铜的熔沸点及硬度均比钾大,其原因是___________________________。
(3)NH3分子的立体构型为_________,中心原子的杂化类型是_________。
(4)N、S、P是组成蛋白质的常见元素。三种元素中第一电离能最大的是_________,电负性最小的是_________。(填元素符号)
(5)已知:Cu2O熔点为1235℃,CuCl熔点为426℃,则可判定Cu2O为_________ (填“离子晶体”或“分子晶体”,下同),CuCl为_________。
(6)氮与铜形成的一种化合物的晶胞结构如图所示。
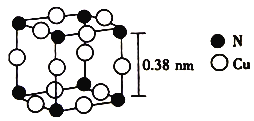
与每个Cu原子紧邻的Cu原子有_________个,阿伏加德罗常数的数值为NA,该晶体的密度为_________ (列出计算式)g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是.![]()
A.在盛有硫酸亚铁铵溶液的试管中,滴加几滴新制氯水,无明显现象,然后滴加KSCN溶液,若观察到溶液变为血红色,则说明硫酸亚铁铵中含有![]()
B.测量某溶液的pH,pH试纸一旦用水湿润,一定会产生实验误差
C.灼烧海带可以在坩埚中进行,也可以在蒸发皿中进行
D.实验室用已知浓度的醋酸溶液滴定未知浓度的氢氧化钠溶液时,选用酚酞做指示剂比用甲基橙做指示剂时带来的误差要小一点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在生产生活中有广泛应用.
![]() 已知:CO可将部分氮的氧化物还原为
已知:CO可将部分氮的氧化物还原为![]() .
.
反应Ⅰ:![]()
反应Ⅱ:![]()
写出CO将![]() 还原为NO的热化学方程式 ______ .
还原为NO的热化学方程式 ______ .
![]() 在密闭容器中充入5molCO和4molNO,发生上述反应I,图1为平衡时NO的体积分数与温度、压强的关系.
在密闭容器中充入5molCO和4molNO,发生上述反应I,图1为平衡时NO的体积分数与温度、压强的关系.
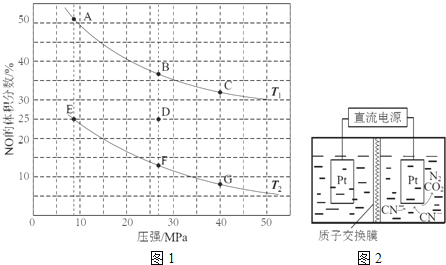
回答下列问题:
![]() 温度:
温度:![]() ______
______ ![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() .
.
![]() 某温度下,在体积为2L的密闭容器中,反应进行10分钟放出热量373kJ,用CO的浓度变化表示的平均反应速率
某温度下,在体积为2L的密闭容器中,反应进行10分钟放出热量373kJ,用CO的浓度变化表示的平均反应速率![]() ______ .
______ .
![]() 某温度下,反应达到平衡状态D点时,容器体积为2L,此时的平衡常数
某温度下,反应达到平衡状态D点时,容器体积为2L,此时的平衡常数![]() ______
______ ![]() 结果精确到
结果精确到![]() ;若在D点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中
;若在D点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中![]() 点中的 ______ 点
点中的 ______ 点
![]() 某温度时,亚硝酸银
某温度时,亚硝酸银![]() 的
的![]() 、
、![]() 的
的![]() ,当向含
,当向含![]() 、
、![]() 混合溶液中加入
混合溶液中加入![]() 溶液至
溶液至![]() 恰好完全沉淀
恰好完全沉淀![]() 即
即![]() 浓度等于
浓度等于![]()
![]() 时,
时,![]() ______ .
______ .
![]() 如图2,在酸性条件下,电解水中
如图2,在酸性条件下,电解水中![]() 可转化为
可转化为![]() 和
和![]() ,请写出阳极的电极反应式 ______ .
,请写出阳极的电极反应式 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请用平衡移动原理解释Na2CO3能使溶液中Fe3+转化成氢氧化物沉淀的原因_______。
(2)取浓度相同的NaOH和HCl溶液,以3:2体积比相混合,所得溶液的pH等于12,则该原溶液的浓度(溶液的体积变化忽略不计)为____________。
(3)常温下,将0.1 mol·L-1 的氨水与0.1 mol·L-1的盐酸按一定体积混合。若两溶液混合后,所得溶液中 c(NH4+)=c(Cl-),混合后所得溶液中溶质的电离方程式为_______;水解离子方程式为_______。
(4)已知:Ksp(FeS)=6.5×10-18,Ksp(CuS)=1.3×10-36。向浓度均为0.1 mol·L-1的FeSO4和CuSO4的混合溶液中滴加Na2S溶液,当加入Na2S溶液至出现两种沉淀,则溶液中c(Fe2+) : c(Cu2+) =___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若用AG来表示溶液的酸度,其表达式为:AG=lg[![]() ]。298 K时,用0.1 mol/L的盐酸溶液滴定10 mL 0.1 mol/L 的MOH溶液,滴定曲线如图所示:下列说法正确的是( )
]。298 K时,用0.1 mol/L的盐酸溶液滴定10 mL 0.1 mol/L 的MOH溶液,滴定曲线如图所示:下列说法正确的是( )
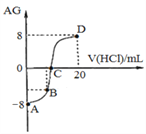
A. 该滴定实验最好选择酚酞作为指示剂
B. C点时加入盐酸溶液的体积等于10 mL
C. 滴定过程中从A点到D点,溶液中水的电离程度先逐渐减小,后逐渐增大
D. 若B点加入的盐酸溶液体积为5mL,则所得溶液中:c(M+)+2c(H+)=c(MOH)+2c(OH)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com