
【题目】(1)请用平衡移动原理解释Na2CO3能使溶液中Fe3+转化成氢氧化物沉淀的原因_______。
(2)取浓度相同的NaOH和HCl溶液,以3:2体积比相混合,所得溶液的pH等于12,则该原溶液的浓度(溶液的体积变化忽略不计)为____________。
(3)常温下,将0.1 mol·L-1 的氨水与0.1 mol·L-1的盐酸按一定体积混合。若两溶液混合后,所得溶液中 c(NH4+)=c(Cl-),混合后所得溶液中溶质的电离方程式为_______;水解离子方程式为_______。
(4)已知:Ksp(FeS)=6.5×10-18,Ksp(CuS)=1.3×10-36。向浓度均为0.1 mol·L-1的FeSO4和CuSO4的混合溶液中滴加Na2S溶液,当加入Na2S溶液至出现两种沉淀,则溶液中c(Fe2+) : c(Cu2+) =___________。
【答案】因Fe3++3H2O= Fe(OH)3+3H+水解显酸性,加入碳酸钠后,H+与CO32-反应,使水解平衡右移动从而产生沉淀 0.05mol/L NH3![]() H2O
H2O ![]() NH4+ +OH- NH4++H2O
NH4+ +OH- NH4++H2O![]() NH3
NH3![]() H2O+H+ 1:2
H2O+H+ 1:2![]() 10-21
10-21
【解析】
(1)根据影响水解因素进行分析;
(2)根据酸碱混合溶液pH的计算进行求解;
(3)根据弱碱和强酸混合后溶液呈中性分析溶解液的成分,在进行相关反应方程式书写;
(4)根据Ksp(FeS)>Ksp(CuS)分析产生相应沉淀的各离子浓度进行计算。
(1) 因为Fe3+水解导致溶液呈酸性,其水解反应离子方程式为:Fe3++3H2O= Fe(OH)3+3H+,碳酸根离子和氢离子反应,从而促进水解平衡向右移动,产生氢氧化铁沉淀,故答案为:因Fe3++3H2O![]() Fe(OH)3+3H+水解显酸性,加入碳酸钠后,H+与CO32-反应,使水解平衡右移动从而产生沉淀;
Fe(OH)3+3H+水解显酸性,加入碳酸钠后,H+与CO32-反应,使水解平衡右移动从而产生沉淀;
(2)设原溶液物质的量浓度为cmol/L,V[NaOH(aq)]=3L,V[HCl(aq)]=2L,二者混合后反应,混合溶液体积为5L,二者混合后反应所得溶液pH=12,则c(OH-)=10-2mol/L,则:3L![]() cmol/L-2L
cmol/L-2L![]() cmol/L==10-2mol/L
cmol/L==10-2mol/L![]() 5L,解得:c=0.05mol/L,故答案为:0.05mol/L;
5L,解得:c=0.05mol/L,故答案为:0.05mol/L;
(3)若氨水与盐酸混合后所得溶液中c(NH4+)=c(Cl-),根据电荷守恒有c(H+)=c(OH-),溶液呈中性,氨水过量,溶液中存在铵根离子的水解平衡NH4++H2O![]() NH3
NH3![]() H2O+H+,一水合氨的电离平衡NH3
H2O+H+,一水合氨的电离平衡NH3![]() H2O
H2O ![]() NH4+ +OH-,故答案:NH3
NH4+ +OH-,故答案:NH3![]() H2O
H2O ![]() NH4+ +OH-
NH4+ +OH-
;NH4++H2O![]() NH3
NH3![]() H2O+H+
H2O+H+
(4)由于Ksp(FeS)>Ksp(CuS),所以在相同条件下CuS的溶解度更小,沉淀会向着生成CuS的方向进行,反应的离子方程式为S2-+Cu2+=CuS↓。当加入Na2S溶液至出现两种沉淀,此时c(S2-)=![]() = 6.5
= 6.5![]() 10-17mol/L,c(Cu2+) =
10-17mol/L,c(Cu2+) =![]() = 2
= 2![]() 10-20mol/L,则c(Fe2+):c(Cu2+)=0.1:2
10-20mol/L,则c(Fe2+):c(Cu2+)=0.1:2![]() 10-20=1:2
10-20=1:2![]() 10-21。
10-21。


科目:高中化学 来源: 题型:
【题目】中学化学涉及多种常数,下列说法正确的是( )
A.两种物质反应,不管怎样书写化学方程式,平衡常数不变
B.某温度下,2L密闭容器中加入4mol A和2mol B发生反应:
3A(g)+2B(g)![]() 4C(s)+2D(g)。平衡时测得n(C)=1.6mol,反应的化学平衡常数表达式为K=
4C(s)+2D(g)。平衡时测得n(C)=1.6mol,反应的化学平衡常数表达式为K=![]()
C.温度一定时,当溶液中c(Ag+ )· c(Cl-)等于Ksp值时,此溶液为AgCl的饱和溶液
D.难溶电解质AB2饱和溶液中,c(A2+ )=x mol·L﹣1,c(B—)=y mol·L﹣1,则Ksp值为4xy2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是生命的源泉、工业的血液、城市的命脉。要保护好河流,河水是重要的饮用水源,污染物通过饮用水可直接毒害人体。也可通过食物链和灌溉农田间接危及健康。请回答下列问题:
(1)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为________,由水电离出的c(OH-)=_______mol/L
(2)纯水在100℃时,pH=6,该温度下1mol/L的NaOH溶液中,由水电离出的 c(OH-)=_______mol/L。
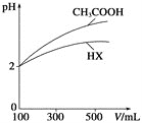
(3)体积均为100mL、pH均为2的CH3COOH溶液与一元酸HX溶液,加水稀释过程中pH与溶液体积的关系如下图所示,则HX的电离平衡常数___(填”大于””小于”或“等于”)CH3COOH的电离平衡常数。
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K==1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.610-11 |
①25℃时,有等浓度的NaCN溶液、Na2CO3液和CH3COONa溶液,三种溶液的pH由大到小的顺序为___。
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为______
(5)25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中 c(CH3COO-)-c(Na+)=_____(填精确值)mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁均为中学化学中常见的单质或化合物,它们之间的转化关系如下图所示(部分产物已略去),下列各组物质中不能按图示关系转化的是
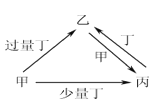
选项 | 甲 | 乙 | 丙 | 丁 |
A | NaOH | NaHSO3 | Na2SO3 | SO2 |
B | Fe | Fe(NO3)3 | Fe(NO3)2 | HNO3 |
C | C | CO2 | CO | O2 |
D | Al | NaAlO2 | Al(OH)3 | NaOH |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.制取Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B.锅炉除水垢时先用纯碱浸泡:CaSO4+CO32-=CaCO3+SO42-
C.泡沫灭火器灭火原理:2Al3++3CO32-+3H2O =2Al(OH)3↓+3CO2↑
D.碳酸钠溶液显碱性:CO32-+2H2OH2CO3+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有Al3+、NH4+、Fe2+、Na+、CO32-、SO42-、Cl-、NO3-中的若干种,若在该溶液中逐滴加入稀盐酸至过量,无明显现象,并得到X溶液,对X溶液进行如下实验,下列结论正确的是( )(忽略水的电离,且原溶液中各离子浓度均为0.5mol/L)
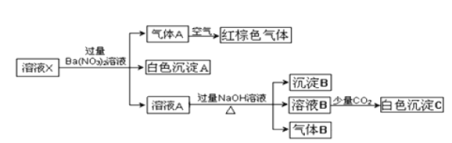
A.原溶液中一定存在NH4+、Fe2+、SO42-B.原溶液中可能合有NO3-和Al3+
C.白色沉淀C可能是![]() D.沉淀B可能是Fe(OH)2和Fe(OH)3的混合物
D.沉淀B可能是Fe(OH)2和Fe(OH)3的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素是空气中含量最多的元素,在自然界中的分布十分广泛,在生物体内亦有极大作用。一定条件下,含氮元素的物质可发生如图所示的循环转化。下列说法正确的是
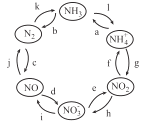
A.图中属于“氮的固定”的是k和l
B.表示循环中发生非氧化还原反应的过程只有a
C.若反应h是在NO2与H2O的作用下实现,则该反应中氧化剂与还原剂的物质的量之比为2:1
D.若反应i是在酸性条件下由 NO3-与Fe2+的作用实现,则该反应的离子方程式为3Fe2++NO3- +4H+ = 3Fe3+ + NO↑ +2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.利用一束强光照射明矾溶液,产生光亮的“通路”,说明明矾一定发生了水解
B.与Al反应放出![]() 的溶液中
的溶液中![]() 、
、![]() 、
、![]() 、
、![]() 有可能大量共存
有可能大量共存
C.![]() 溶液中通入过量
溶液中通入过量![]() 的离子方程式:
的离子方程式:![]()
D.等体积、等物质的量浓度的NaX溶液和弱酸HX混合后的溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的前四周期元素,X、Z的周期序数=族序数,由这四种元素组成的单质或化合物存在如图所示的转化关系,其中甲、戊是两常见的金属单质,丁是非金属单质,其余为氧化物且丙为具有磁性的黑色晶体。下列说法正确的是
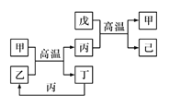
A. W的原子序数是Z的两倍,金属性强于Z
B. W元素在周期表中的位置是第四周期VIII族
C. 丙属于两性氧化物
D. 等物质的量的甲和戊完全溶于稀硝酸,消耗的HNO3的量一定相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com