
ЎҫМвДҝЎҝЎ°О»ЦГЎұЎўЎ°Ҫб№№ЎұәНЎ°РФЦКЎұКЗОТГЗС§П°ФӘЛШЦЬЖЪВЙөДЦШТӘЛјВ·ЎЈ
ЈЁ1Ј©ОТГЗҝЙТФёщҫЭФӯЧУҪб№№КҫТвНјАҙНЖІвФӘЛШФЪЦЬЖЪұнЦРөДО»ЦГЈ¬ТФПВОӘXФӘЛШөДФӯЧУҪб№№КҫТвНј(Оҙ»ӯИ«)Јә
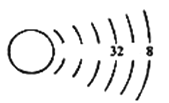
ЗлРҙіцXФӘЛШФЪЦЬЖЪұнЦРөДО»ЦГ_____________________ЎЈ
ЈЁ2Ј©ОТГЗТІҝЙТФёщҫЭОпЦКРФЦКНЖІвёГФӘЛШФЪФӘЛШЦЬЖЪұнЦРөДО»ЦГЈ¬ИзYФӘЛШЧоёЯјЫСх»ҜОпјИҝЙТФИЬУЪЕЁСОЛбЈ¬ТІҝЙТФИЬУЪNaOHИЬТәЈ»ЖдЧоёЯјЫСх»ҜОп¶ФУҰөДЛ®»ҜОпјИҝЙТФУлЛб·ҙУҰЈ¬ТІҝЙТФУлјо·ҙУҰЈ»1molёГФӘЛШЧоёЯјЫСх»ҜОп¶ФУҰөДЛ®»ҜОпФЪУлСОЛб·ҙУҰКұЈ¬Чо¶аДЬПыәД4molHClЎЈЗлРҙіцYФӘЛШФЪЦЬЖЪұнЦРөДО»ЦГ_____________________ЎЈ
ЈЁ3Ј©·ҙ№эАҙЈ¬ЦӘөАБЛФӘЛШөДО»ЦГ№ШПөЈ¬ОТГЗҝЙТФНЖІвФӘЛШРФЦК»тХЯФӘЛШ¶ФУҰөДөҘЦКј°»ҜәПОпөДРФЦКЎЈЛДЦЦ¶МЦЬЖЪФӘЛШФЪЦЬЖЪұнЦРөДО»ЦГИзПВНјЛщКҫЈ¬ЖдЦРЦ»УРMОӘҪрКфФӘЛШЎЈФтYәНZФӯЧУ°лҫ¶ёьҙуөДКЗ____ЈЁМоФӘЛШ·ыәЕ»т»ҜС§КҪЈ¬ПВН¬Ј©Ј¬YәНXЧоёЯјЫСх»ҜОп¶ФУҰЛ®»ҜОпөДЛбРФёьИхөДКЗ______ЎЈ
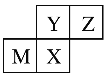
Ўҫҙр°ёЎҝөЪБщЦЬЖЪ0Че өЪЛДЦЬЖЪўфAЧе C H2SiO3
ЎҫҪвОцЎҝ
(1)ёГФӘЛШУР6ёцөзЧУІгЈ¬ФтОӘөЪБщЦЬЖЪЈ¬ЧоНвІгөзЧУКэОӘ8Ј¬ФтОӘ0ЧеФӘЛШЈ¬ЛщТФXФӘЛШФЪЦЬЖЪұнЦРөДО»ЦГОӘөЪБщЦЬЖЪ0ЧеЈ»
(2)ёщҫЭМвДҝРЕПўҝЙЦӘёГФӘЛШөДЧоёЯјЫСх»ҜОпәНЧоёЯјЫСх»ҜОпөДЛ®»ҜОпОӘБҪРФОпЦКЈ¬ёщҫЭ¶ФҪЗПЯ№жФтЈ¬ёГФӘЛШУҰёГО»УЪAlФӘЛШөДЧуЙП·Ҫ»тХЯУТПВ·ҪЈ»1molёГФӘЛШЧоёЯјЫСх»ҜОп¶ФУҰөДЛ®»ҜОпФЪУлСОЛб·ҙУҰКұЈ¬Чо¶аДЬПыәД4molHClЈ¬ФтёГФӘЛШЧоёЯјЫСх»ҜОп¶ФУҰөДЛ®»ҜОпОӘY(OH)4Ј¬ёГФӘЛШЧоёЯХэјЫОӘ+4јЫЈ¬ФтёГФӘЛШУҰёГО»УЪөЪўфAЧеЈ¬ЧЫәП·ЦОцҝЙЦӘYФӘЛШО»УЪөЪЛДЦЬЖЪўфAЧеЈ»
(3)ёщҫЭФӘЛШЦЬЖЪұнЦР¶МЦЬЖЪІҝ·ЦөДҪб№№әНФӘЛШО»ЦГҝЙЦӘЈәYЎўZО»УЪөЪ¶юЦЬЖЪЈ¬MЎўXО»УЪөЪИэЦЬЖЪЈ¬¶шөЪИэЦЬЖЪЦРMОӘҪрКфФӘЛШЎўXОӘ·ЗҪрКфФӘЛШЈ¬ФтҪрКфMОӘAlЈ¬XОӘSiЈ¬ҙУ¶шНЖ¶ПіцYОӘCЈ¬ZОӘNЈ¬Н¬ЦЬЖЪЧФЧуөҪУТФӯЧУ°лҫ¶ЦрҪҘјхРЎЈ¬ЛщТФCөДФӯЧУ°лҫ¶ёьҙуЈ»Н¬ЦчЧеФӘЛШЧФЙП¶шПВ·ЗҪрКфРФјхИхЈ¬ЛщТФ·ЗҪрКфРФC>SiЈ¬ЛщТФH2SiO3ЛбРФёьИхЎЈ



| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝОӘБЛІв¶ЁДіУР»ъОпAөДҪб№№Ј¬ЧцИзПВКөСйЈә
ўЩҪ«2.3 gёГУР»ъОпНкИ«ИјЙХЈ¬ЙъіЙ0.1 mol CO2әН2.7 gЛ®Ј»
ўЪУГЦКЖЧТЗІв¶ЁЖдПа¶Ф·ЦЧУЦКБҝЈ¬өГИзНјТ»ЛщКҫөДЦКЖЧНјЈ»
ўЫУГәЛҙЕ№ІХсТЗҙҰАнёГ»ҜәПОпЈ¬өГөҪИзНј¶юЛщКҫНјЖЧЈ¬НјЦРИэёц·еөДГж»эЦ®ұИКЗ1ЎГ2ЎГ3ЎЈ
КФ»ШҙрПВБРОКМвЈә
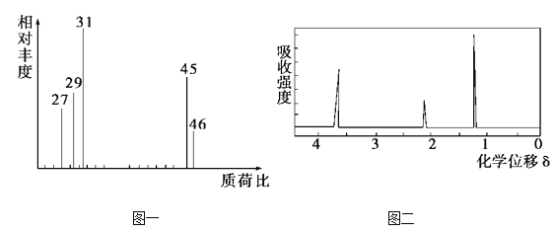
(1)УР»ъОпAөДПа¶Ф·ЦЧУЦКБҝКЗ_______
(2)УР»ъОпAөДКөСйКҪКЗ________
(3)ДЬ·сёщҫЭAөДКөСйКҪИ·КөAөД·ЦЧУКҪ______
(4)РҙіцёГОпЦКөДҪб№№јтКҪЈә_______________________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝКөСйКТУыМҪҫҝCO»№ФӯCuOЈ¬ЙијЖИзНјЛщКҫЧ°ЦГ(јРіЦЧ°ЦГВФИҘ)ЎЈПВБРЛө·ЁХэИ·өДКЗ
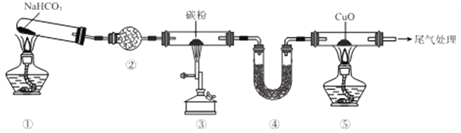
A. ўЪЎўўЬЦРҫщҝЙКўЧ°јоКҜ»Т
B. јУИИөДЛіРтОӘўЫЎўўЩЎўўЭ
C. ўЩЎўўЫЎўўЭЦРҫщ·ўЙъСх»Ҝ»№Фӯ·ҙУҰ
D. ҝЙҪ«ОІЖшУГөј№ЬНЁИлөҪўЭөДҫЖҫ«өЖҙҰЧЖЙХ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝКөСйКТАыУГПВБРЧ°ЦГҝЙІвБҝТ»¶ЁЦКБҝөДёЦІДЦРөДә¬МјБҝ(Іҝ·ЦјУіЦЧ°ЦГТСВФИҘ)ЎЈПВБРУР№ШЕР¶ПХэИ·өДКЗЈЁ Ј©

A. КөСйКұЈ¬ПИҙтҝӘK1ЎўK2,№ШұХK3Ј¬ҙУaҙҰНЁИлN2Ј¬ДҝөДКЗЕЕіцЧ°ЦГЦРөДO2
B. өгИјҫЖҫ«өЖЗ°,РиТӘҙтҝӘK1Ўў№ШұХK2,ҙтҝӘK3ЎўK1ЖрөҪЖҪәвЖшС№өДЧчУГ
C. Ч°ЦГўЪЦРөДЛбРФKMnO4ИЬТәОьКХSO2Ј¬Ч°ЦГўЫКўУРЕЁБтЛб,ЖрөҪёЙФпЧчУГ
D. КөСйЗ°әуРиіЖИЎЧ°ЦГўЬәНЧ°ЦГўЭөДЦКБҝЈ¬ІЕДЬЧјИ·өШІвөГёЦІДөДә¬МјБҝ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ°ҙТӘЗу»ШҙрПВБРОКМвЈә
ЈЁ1Ј©ТФCO2әНNH3ОӘФӯБПәПіЙДтЛШКЗАыУГCO2өДіЙ№Ұ·¶АэЎЈФЪДтЛШәПіЙЛюЦРөДЦчТӘ·ҙУҰҝЙұнКҫИзПВЈә
·ҙУҰўсЈә2NH3(g)+CO2(g)![]() NH2COONH4ЈЁsЈ© ЎчH1
NH2COONH4ЈЁsЈ© ЎчH1
·ҙУҰўтЈәNH2COONH4(s)![]() CO(NH2)2(s)+H2O(g) ЎчH2= +72.49kJ/mol
CO(NH2)2(s)+H2O(g) ЎчH2= +72.49kJ/mol
ЧЬ·ҙУҰЈә2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) ЎчH3= -86.98kJ/mol
CO(NH2)2(s)+H2O(g) ЎчH3= -86.98kJ/mol
ўЩ·ҙУҰўсөДЎчH1=______________ЎЈ
ўЪТ»¶ЁОВ¶ИПВЈ¬ФЪМе»э№М¶ЁөДГЬұХИЭЖчЦР°ҙ nЈЁNH3Ј©:nЈЁCO2Ј©=2:1 ҪшРР·ҙУҰўсЈ¬ПВБРДЬЛөГч·ҙУҰўсҙпөҪБЛЖҪәвЧҙМ¬өДКЗ_______ЈЁМоРтәЕЈ©ЎЈ
A ИЭЖчДЪЖшМеЧЬС№ЗҝІ»ФЩұд»Ҝ
B NH3УлCO2өДЧӘ»ҜВКПаөИ
C ИЭЖчДЪ»мәПЖшМеөДГЬ¶ИІ»ФЩұд»Ҝ
ЈЁ2Ј©ФЪТ»¶ЁМе»эөДГЬұХИЭЖчЦРҪшРРИзПВ»ҜС§·ҙУҰЈәCO2(g)Ј«H2(g)![]() CO(g)Ј«H2O(g)Ј¬Жд»ҜС§ЖҪәвіЈКэЈЁKЈ©әНОВ¶ИЈЁtЈ©өД№ШПөИзПВұнЛщКҫЈә
CO(g)Ј«H2O(g)Ј¬Жд»ҜС§ЖҪәвіЈКэЈЁKЈ©әНОВ¶ИЈЁtЈ©өД№ШПөИзПВұнЛщКҫЈә
t/Ўж | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
»ШҙрПВБРОКМвЈә
ўЩёГ·ҙУҰөД»ҜС§ЖҪәвіЈКэұнҙпКҪОӘKЈҪ___________ЎЈ
ўЪёГ·ҙУҰОӘ____________ЈЁМоЎ°ОьИИЎұ»тЎ°·ЕИИЎұЈ©·ҙУҰЎЈ
ўЫДіОВ¶ИПВЈ¬ЖҪәвЕЁ¶И·ыәППВКҪЈәc(CO2)ЎӨc(H2)ЈҪc(CO)ЎӨc(H2O)Ј¬КФЕР¶ПҙЛКұөДОВ¶ИОӘ________ЎжЎЈ
ўЬФЪ800 ЎжКұЈ¬·ўЙъЙПКц·ҙУҰЈ¬ДіТ»КұҝМІвөГИЭЖчДЪёчОпЦКөДЕЁ¶И·ЦұрОӘc(CO2)ОӘ2 molЎӨLЈӯ1Ј¬c(H2)ОӘ1.5 molЎӨLЈӯ1Ј¬c(CO)ОӘ1 molЎӨLЈӯ1Ј¬c(H2O)ОӘ3 molЎӨLЈӯ1Ј¬ҙЛКұ·ҙУҰПт________ЈЁМоЎ°ХэПтЎұ»тЎ°ДжПтЎұЈ©ҪшРРЎЈ
ЈЁ3Ј©№ӨТөЙПҙУ·ПЗҰРоөзіШ·ПТә»ШКХЗҰөД№эіМЦРЈ¬іЈУГҙҝјоИЬТәУлҙҰАнәуөДЗҰёаЈЁЦчТӘә¬PbSO4Ј©·ўЙъ·ҙУҰЈәPbSO4ЈЁsЈ©Ј«CO32ЈӯЈЁaqЈ©![]() PbCO3ЈЁsЈ©Ј«SO42ЈӯЈЁaqЈ©ЎЈТСЦӘИЬ¶И»эіЈКэЈәKspЈЁPbSO4Ј©=1.6ЎБ10-8,KspЈЁPbCO3Ј©=7.4ЎБ10-14,ФтёГ·ҙУҰөД»ҜС§ЖҪәвіЈКэK =____ЎЈ
PbCO3ЈЁsЈ©Ј«SO42ЈӯЈЁaqЈ©ЎЈТСЦӘИЬ¶И»эіЈКэЈәKspЈЁPbSO4Ј©=1.6ЎБ10-8,KspЈЁPbCO3Ј©=7.4ЎБ10-14,ФтёГ·ҙУҰөД»ҜС§ЖҪәвіЈКэK =____ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ°ҙТӘЗуРҙіцПВБР·ҙУҰөД»ҜС§·ҪіМКҪЎЈ
(1)МъЧцҙЯ»ҜјБЈ¬ұҪУлдеөҘЦК·ҙУҰ_________________Ј»
(2)CH3CH2CH2OH·ўЙъПыИҘ·ҙУҰЙъіЙұыП©_____________Ј»
(3)ұҪТТП©ЈЁ![]() Ј©ФЪККөұТэ·ўјБЧчУГПВЙъіЙҫЫұҪТТП©_________________________ЎЈ
Ј©ФЪККөұТэ·ўјБЧчУГПВЙъіЙҫЫұҪТТП©_________________________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ.ФЪТ»¶ЁМе»эәНТ»¶ЁМхјюПВУР·ҙУҰN2(g)+3H2(g)![]() 2NH3(g),ПЦ·ЦұрҙУБҪМхНҫҫ¶ҪЁБўЖҪәв:
2NH3(g),ПЦ·ЦұрҙУБҪМхНҫҫ¶ҪЁБўЖҪәв:
ўс.ЖрКјЕЁ¶ИN2:1 molЎӨL-1,H2:3 molЎӨL-1
ўт.ЖрКјЕЁ¶ИN2:2 molЎӨL-1,H2:6 molЎӨL-1
ФтПВБРРрКцХэИ·өДКЗ( )
A. ўсәНўтБҪНҫҫ¶ҙпөҪЖҪәвКұ,МеПөДЪёчіЙ·ЦөДМе»э·ЦКэПаН¬
B. ҙпөҪЖҪәвКұ,Нҫҫ¶ўсөД·ҙУҰЛЩВКv(H2)өИУЪНҫҫ¶ўтөД·ҙУҰЛЩВКv(H2)
C. ҙпөҪЖҪәвКұ,Нҫҫ¶ўтМеПөДЪ»мәПЖшМеөДС№ЗҝКЗНҫҫ¶ўсДЪ»мәПЖшМеС№ЗҝөД2ұ¶
D. ҙпөҪЖҪәвКұ,Нҫҫ¶ўсМеПөДЪ»мәПЖшМеөДГЬ¶ИОӘНҫҫ¶ўтМеПөДЪ»мәПЖшМеөДГЬ¶ИөД
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝіЈОВПВЈ¬![]() Ј¬іЈОВПВ
Ј¬іЈОВПВ![]() ФЪЛ®ЦРөДіБөнИЬҪвЖҪәвЗъПЯИзНјЛщКҫЎЈПВБРЛө·ЁХэИ·өДКЗ( )
ФЪЛ®ЦРөДіБөнИЬҪвЖҪәвЗъПЯИзНјЛщКҫЎЈПВБРЛө·ЁХэИ·өДКЗ( )
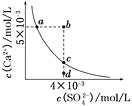
A.ФЪИОәОИЬТәЦРЈ¬![]() Ўў
Ўў![]() ҫщПаөИ
ҫщПаөИ
B.bөгҪ«УРіБөнЙъіЙЈ¬ЖҪәвәуИЬТәЦР![]() Т»¶ЁөИУЪ
Т»¶ЁөИУЪ![]()
C.aөг¶ФУҰөД![]() өИУЪcөг¶ФУҰөД
өИУЪcөг¶ФУҰөД![]()
D.dөгИЬТәНЁ№эХф·ўҝЙТФұдөҪcөг
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБРЛө·ЁХэИ·өДКЗЈ®![]()
A.ФЪКўУРБтЛбСЗМъп§ИЬТәөДКФ№ЬЦРЈ¬өОјУјёөОРВЦЖВИЛ®Ј¬ОЮГчПФПЦПуЈ¬И»әуөОјУKSCNИЬТәЈ¬Иф№ЫІмөҪИЬТәұдОӘСӘәмЙ«Ј¬ФтЛөГчБтЛбСЗМъп§ЦРә¬УР![]()
B.ІвБҝДіИЬТәөДpHЈ¬pHКФЦҪТ»ө©УГЛ®КӘИуЈ¬Т»¶Ё»бІъЙъКөСйОуІо
C.ЧЖЙХәЈҙшҝЙТФФЪЫбЫцЦРҪшРРЈ¬ТІҝЙТФФЪХф·ўГуЦРҪшРР
D.КөСйКТУГТСЦӘЕЁ¶ИөДҙЧЛбИЬТәөО¶ЁОҙЦӘЕЁ¶ИөДЗвСх»ҜДЖИЬТәКұЈ¬СЎУГ·УМӘЧцЦёКҫјБұИУГјЧ»щіИЧцЦёКҫјБКұҙшАҙөДОуІоТӘРЎТ»өг
Ійҝҙҙр°ёәНҪвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com