
【题目】常温下,![]() ,常温下
,常温下![]() 在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
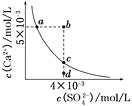
A.在任何溶液中,![]() 、
、![]() 均相等
均相等
B.b点将有沉淀生成,平衡后溶液中![]() 一定等于
一定等于![]()
C.a点对应的![]() 等于c点对应的
等于c点对应的![]()
D.d点溶液通过蒸发可以变到c点
【答案】C
【解析】
该图中的是平衡曲线,线上的任意点都是平衡状态,b和d不是平衡状态,
A.CaSO4饱和溶液中c(Ca2+)=c(SO42-),若加Na2SO4固体,c(SO42-)增大,c(Ca2+)减小;
B.b点Qc>Ksp,有沉淀生成;
C.Ksp与温度有关,a和c的Ksp相等;
D.蒸发使离子浓度增大,d点不可能到c点。
A.CaSO4饱和溶液中c(Ca2+)=c(SO42-),若加Na2SO4固体,c(SO42-)增大,c(Ca2+)减小,c(SO42-)>c(Ca2+),故A错误;
B.根据图示数据,可以看出b点Qc=2×l0-5>Ksp,所以会生成沉淀,平衡向生成沉淀的方向进行,由于c(Ca2+)>c(SO42-),则c(SO42-)小于3×l0-3mol/L,故B错误。
C.Ksp是一常数,温度不变Ksp不变,在曲线上的任意一点Ksp都相等,故C正确;
D.d为不饱和溶液,蒸发时硫酸根的浓度会增大,所以d点溶液通过蒸发不能变到c点,故D错误。
故选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】肼(N2H4)在不同条件下分解产物不同,200 ℃时在Cu表面分解的机理如图甲所示。已知200 ℃时:
反应Ⅰ:3N2H4(g)===N2(g)+4NH3(g) ΔH1=-32.9 kJ·mol-1
反应Ⅱ:N2H4(g)+H2(g)===2NH3(g) ΔH2=-41.8 kJ·mol-1
下列说法中不正确的是 ( )
A.图所示过程①、②都是放热反应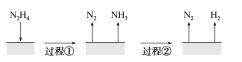
B.反应Ⅱ的能量过程示意图如图所示
C.断裂3 mol N2H4(g)中的化学键吸收的能量小于形成1 mol N2(g)和4 mol NH3(g)中的化学键释放的能量
D.200 ℃时,肼分解生成氮气和氢气的热化学方程式为N2H4(g)===N2(g)+2H2(g) ΔH=+50.7 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“位置”、“结构”和“性质”是我们学习元素周期律的重要思路。
(1)我们可以根据原子结构示意图来推测元素在周期表中的位置,以下为X元素的原子结构示意图(未画全):
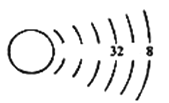
请写出X元素在周期表中的位置_____________________。
(2)我们也可以根据物质性质推测该元素在元素周期表中的位置,如Y元素最高价氧化物既可以溶于浓盐酸,也可以溶于NaOH溶液;其最高价氧化物对应的水化物既可以与酸反应,也可以与碱反应;1mol该元素最高价氧化物对应的水化物在与盐酸反应时,最多能消耗4molHCl。请写出Y元素在周期表中的位置_____________________。
(3)反过来,知道了元素的位置关系,我们可以推测元素性质或者元素对应的单质及化合物的性质。四种短周期元素在周期表中的位置如下图所示,其中只有M为金属元素。则Y和Z原子半径更大的是____(填元素符号或化学式,下同),Y和X最高价氧化物对应水化物的酸性更弱的是______。
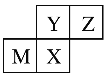
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中的有机物种类丰富,在衣食住行等多方面应用广泛,其中乙醇是比较常见的有机物。
(1)乙醇是无色有特殊香味的液体,密度比水_______。
(2)工业上用乙烯与水反应可制得乙醇,该反应的化学方程式为__________________(不写反应条件),原子利用率是______________。
(3)属于乙醇的同分异构体的是_______(选填编号)。
A.![]() B.
B.![]() C.甲醇 D.CH3—O—CH3 E.HO—CH2CH2—OH
C.甲醇 D.CH3—O—CH3 E.HO—CH2CH2—OH
(4)乙醇能够发生氧化反应:
① 46 g乙醇完全燃烧消耗_______mol氧气。
② 乙醇在铜作催化剂的条件下可被氧气氧化为乙醛,反应的化学方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学涉及多种常数,下列说法正确的是( )
A.两种物质反应,不管怎样书写化学方程式,平衡常数不变
B.某温度下,2L密闭容器中加入4mol A和2mol B发生反应:
3A(g)+2B(g)![]() 4C(s)+2D(g)。平衡时测得n(C)=1.6mol,反应的化学平衡常数表达式为K=
4C(s)+2D(g)。平衡时测得n(C)=1.6mol,反应的化学平衡常数表达式为K=![]()
C.温度一定时,当溶液中c(Ag+ )· c(Cl-)等于Ksp值时,此溶液为AgCl的饱和溶液
D.难溶电解质AB2饱和溶液中,c(A2+ )=x mol·L﹣1,c(B—)=y mol·L﹣1,则Ksp值为4xy2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烷的催化裂解可按下列两种方式进行:C4H10→C2H6+C2H4; C4H10→CH4+C3H6;某化学兴趣小组的同学为探究丁烷裂解气中CH4和C2H6的比例关系,设计如图所示实验:
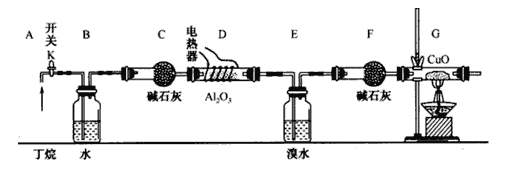
注:CuO能将烃氧化成CO2和H2O;A12O3是丁烷裂解的催化剂,G后面装置已省略。如图连接好装置后(部分夹持装置已略去),需进行的实验操作有:
①给D、G装置加热:②检査整套装置的气密性;③排尽装置中的空气。
(1)这三步操作的先后顺序依次是____________。
(2)简要说明检验空气排尽的方法:_______________________________________________。
(3)B装置所起的作用是__________________________________________。
(4)假设丁烷完全裂解,流经各装置中的气体能完全反应。当(E和F)装置的总质量比反应前增加了 1.82g, G装置中固体质量减少了 4.l6g,则丁烷的裂解产物中n(CH4)∶n(C2H6)=_____________。
(5)若对E装置中的混合物再按以下流程实验:

①分离操作I、Ⅱ的名称是I_____________、 II_______________;
②Na2SO3溶液的作用是(用离子方程式表示)__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中正确的有
①0.1mol丙烯酸中含有双键的数目为0.1NA
②12g金刚石中,碳碳共价键数为4NA
③常温下,21g C3H6和C4H8的混合物中含有的碳原子数为1.5NA
④2g ![]() 中含有的质子数、中子数、电子数均为NA
中含有的质子数、中子数、电子数均为NA
⑤常温常压下,S2和S6的混合物共6.4g,其中所含硫原子数一定为0.2NA
⑥10mL 18mol/L的浓硫酸与足量的镁反应时转移的电子数为0.18NA
A. ①⑥B. ④⑤⑥C. ③④⑤D. ①②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有Al3+、NH4+、Fe2+、Na+、CO32-、SO42-、Cl-、NO3-中的若干种,若在该溶液中逐滴加入稀盐酸至过量,无明显现象,并得到X溶液,对X溶液进行如下实验,下列结论正确的是( )(忽略水的电离,且原溶液中各离子浓度均为0.5mol/L)
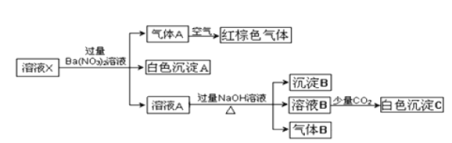
A.原溶液中一定存在NH4+、Fe2+、SO42-B.原溶液中可能合有NO3-和Al3+
C.白色沉淀C可能是![]() D.沉淀B可能是Fe(OH)2和Fe(OH)3的混合物
D.沉淀B可能是Fe(OH)2和Fe(OH)3的混合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com