
| A、溶液Y中加入过量的NaOH溶液后过滤,滤液和沉淀中各含两种金属元素 |
| B、该矿石成分中能溶于盐酸的都是碱性氧化物,不溶的是酸性氧化物 |
| C、溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+ |
| D、沉淀X的成分是SiO2 |


科目:高中化学 来源: 题型:
| A、1mol乙烷分子中含有8NA个共价键 |
| B、0.05mol熔融的KHSO4中含有阳离子的数目为0.05 NA |
| C、标准状况下,22.4L甲醇的分子数为NA |
| D、1mol/L的氯化铵溶液含氮原子数为 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Br2 |
| Cu/O2 |
| △ |

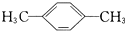 的系统命名为
的系统命名为
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
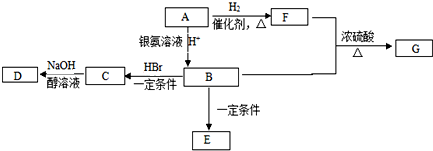
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学设计实验探究构成原电池的条件,装置如下:
某同学设计实验探究构成原电池的条件,装置如下:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、粗盐提纯操作的顺序是:溶解、过滤、蒸发、洗涤 |
| B、实验室制取氧气完毕后,应先取出集气瓶,再取出导管,最后停止加热 |
| C、不慎将浓硫酸洒在桌上,应先用烧碱溶液中和,再用湿布抹净 |
| D、用试管夹夹持试管时,把试管夹从试管底部往上套,夹在试管中上部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com