
| A. | 氯元素在自然界中只以化合态形式存在 | |
| B. | H2在Cl2中燃烧会产生苍白色火焰 | |
| C. | 漂粉精是混合物,其有效成分是次氯酸钠 | |
| D. | 久置氯水最终变为稀盐酸 |
分析 A.氯元素是活泼非金属元素,自然界中无游离态;
B.氢气在氯气中燃烧放出苍白色火焰;
C.漂白精是氯化钙和次氯酸钙的混合物,有效成分为次氯酸钙;
D.氯水中氯气和水反应生成盐酸和次氯酸,次氯酸见光分解生成氧气和盐酸,随反应进行最后为稀盐酸;
解答 解:A.氯元素是活泼非金属元素,自然界中无游离态,只以化合态形式存在,故A正确;
B.氢气在氯气中燃烧放出苍白色火焰,生成氯化氢,故B正确;
C.漂白精是氯气和氢氧化钙反生成的氯化钙和次氯酸钙的混合物,有效成分为次氯酸钙,故C错误;
D.氯水中氯气和水反应生成盐酸和次氯酸,次氯酸见光分解生成氧气和盐酸,2HClO$\frac{\underline{\;光\;}}{\;}$2HCl+O2↑,促进平衡正向进行,随反应进行最后为稀盐酸,故D正确;
故选C.
点评 本题考查了氯及其化合物性质和制备,主要是氯水成分判断,漂白精的制备原理,掌握基础是解题关键,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | +5 | B. | +4 | C. | +3 | D. | +2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将少量SO2气体通入NaClO溶液中:2ClO-+SO2+H2O→SO32-+2HClO | |
| B. | 硫化氢气体通入硫酸亚铁溶液产生黑色硫化亚铁沉淀:H2S+Fe2+→FeS↓+2H+ | |
| C. | 向偏铝酸钠溶液中通入过量CO2:AlO2-+CO2+2H2O→Al(OH)3↓+HCO3- | |
| D. | 向硫酸铝铵[NH4Al(SO4)2]溶液中滴加足量Ba(OH)2溶液NH4++Al3++2SO42-+2Ba2++5OH-→AlO2-+2BaSO4↓+NH3•H2O+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
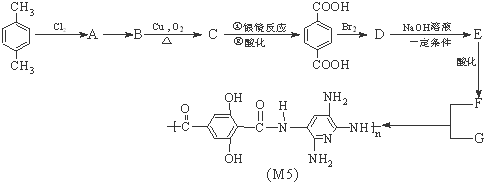
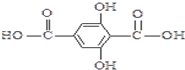 .
.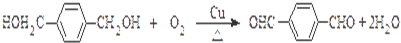 ,
,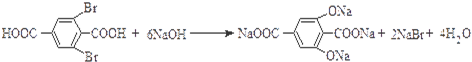 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol SO2和足量的O2反应,必定生成2mol SO3 | |
| B. | 当v(正)>V(逆)时,随着反应的进行,反应物的物质的量逐渐减小 | |
| C. | 正反应速率之比为v(SO2):v(O2):v(SO3)=2:1:2时,反应达到平衡 | |
| D. | 反应达到平衡后,升高温度,平衡不一定发生移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | NaHCO3 | Na2CO3 | NaF | NaClO |
| pH | 8.4 | 11.6 | 7.5 | 9.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com