
【题目】A、B、C、D、E分别是铁或铁的化合物。其中D是一种红褐色沉淀。其相互反应关系如图所示:
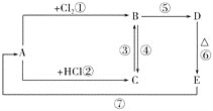
根据如图所示变化,按要求回答下列问题:
(1)写出A、E的化学式:A__,E__;
(2)写出其中几步反应的化学方程式:
C→B:___;
B→D:___;
E→A:___。
(3)C中加入NaOH溶液,看到的现象是__。
【答案】Fe Fe2O3 2FeCl2+Cl2=2FeCl3 FeCl3+3NaOH=Fe(OH)3↓+3NaCl Fe2O3+3CO![]() 2Fe+3CO2(或Fe2O3+2Al
2Fe+3CO2(或Fe2O3+2Al![]() 2Fe+Al2O3) 出现白色沉淀,迅速变成灰绿色,最终变成红褐色
2Fe+Al2O3) 出现白色沉淀,迅速变成灰绿色,最终变成红褐色
【解析】
D是一种红褐色沉淀,应为Fe(OH)3,由转化关系可知E为Fe2O3,A为Fe,则B为FeCl3,C为FeCl2,结合对应物质的性质以及题目要求解答该题。
(1)由以上分析可知A为Fe,E为Fe2O3,
故答案为:Fe;Fe2O3;
(2)C为FeCl2,可与氯气反应生成FeCl3,方程式为2FeCl2+Cl2=2FeCl3,B为FeCl3,可与氢氧化钠溶液反应生成Fe(OH)3,方程式为FeCl3+3NaOH=Fe(OH)3↓+3NaCl,可经一氧化碳高温下还原(或铝热反应)生成Fe,方程式为Fe2O3+3CO![]() 2Fe+3CO2(或Fe2O3+2Al
2Fe+3CO2(或Fe2O3+2Al![]() 2Fe+Al2O3),
2Fe+Al2O3),
故答案为:2FeCl2+Cl2=2FeCl3;FeCl3+3NaOH=Fe(OH)3↓+3NaCl;Fe2O3+3CO![]() 2Fe+3CO2(或Fe2O3+2Al
2Fe+3CO2(或Fe2O3+2Al![]() 2Fe+Al2O3);
2Fe+Al2O3);
(3)C为FeCl2,可与氢氧化钠溶液反应生成Fe(OH)2,出现白色沉淀,Fe(OH)2不稳定已被空气中的氧气氧化,迅速变成灰绿色,最终变成红褐色,
故答案为:出现白色沉淀,迅速变成灰绿色,最终变成红褐色。


科目:高中化学 来源: 题型:
【题目】根据原电池原理可以设计原电池,实现多种用途
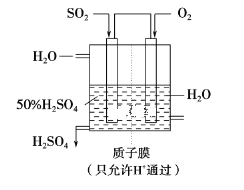
(1) 可以用如图所示装置吸收SO2并制取硫酸,写出通入SO2和O2的电极的电极反应式及反应的总方程式。
负极________________________________
正极________________________________
总反应_________________________________________。
(2) 如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒。当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流。
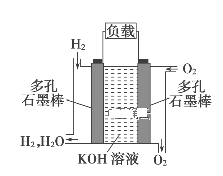
试回答下列问题:
①图中通过负载的电子流动方向________(填“向左”或“向右”)。
②写出氢氧燃料电池工作时电极反应方程式。
正极:_________________________,负极:____________________________,
③若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,
正极反应式为__________________________________________________;
负极反应式为__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验是科学探究过程中的一种重要方法,掌握化学实验的基本操作和物质的制备、转化及性质的探究尤为重要,请结合所学化学实验知识回答以下问题。某化学课外活动小组为了验证元素化学性质递变规律,进行如下实验探究。
探究:验证氯元素的非金属性比硫元素的非金属性强,设计如下实验:
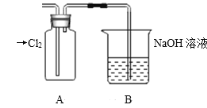
(1)装置A中盛放的试剂是____(填选项),化学反应方程式是___。
A.Na2SO3溶液 B.Na2S溶液 C.Na2SO4溶液
(2)下列不能用于验证氯元素比硫元素非金属性强的依据为______(填选项)。
①HCl的溶解度比H2S大 ②HCl的酸性比H2S强 ③HCl的稳定性比H2S大④HCl的还原性比H2S弱⑤HClO4的酸性比H2SO4强 ⑥还原性:Cl-<S2- ⑦Cl2能与H2S反应生成S ⑧在周期表中Cl处于S同周期的右侧
(3)若要验证非金属性:Cl>I,装置A中加入淀粉碘化钾混合溶液,观察到装置A中溶液_______的现象,即可证明。用元素周期律理论解释非金属性Cl>I的原因:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用0.5mol/L NaOH溶液和0.5mol/L硫酸溶液进行中和热的测定。
Ⅰ.准备仪器
(1)环形玻璃搅拌棒__________(填“能”或“不能”)改为环形金属(如铜)棒,其原因是__________。
(2)碎泡沫的作用是______________,终止温度应为反应的最________(填“高”或“终”)温度。
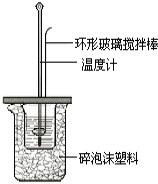
II.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
(1)四次实验所得到的温度平均值为__________℃。
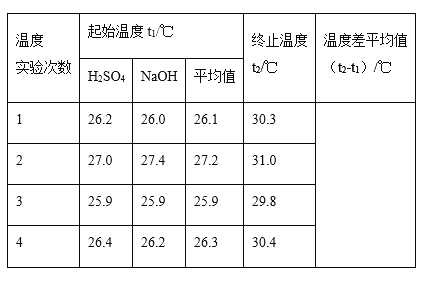
(2)取50mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如表。
①近似认为0.5mol/LNaOH溶液和0.5mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J·g-1·℃-1。则中和热△H =_____(取小数点后一位)。
②上述实验数值结果与573KJ·mol-1有偏差,产生偏差的原因可能是(填字母)_____。
a.实验装置保温、隔热效果差
b. 量取NaOH溶液的体积时仰视读数
c. 分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.反应时未用搅拌器搅拌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同波长的光可以使有机化合物之间相互转化。如俘精酸酐类化合物甲、乙可以发生如下转化:
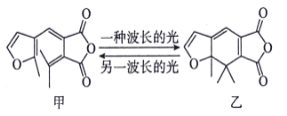
下列说法错误的是( )
A.甲与乙互为同分异构体
B.甲生成乙的反应类型为加成反应
C.甲、乙两种分子中均没有手性碳原子
D.1mol甲分子与足量NaOH溶液反应时消耗2mo1NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可利用反应2Cr2O72-+3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH检测乙醇。下列说法错误的是( )
A.基态Cr3+的核外电子排布式为3d3
B.[Cr(H2O)6]3+中与Cr3+形成配位键的原子是氧原子
C.CH3COOH分子中含有7个![]() 键
键
D.已知CrO42-是以Cr为中心的四面体结构,则Cr2O72-结构中含有两个四面体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组拟用酸性KMnO4溶液与H2C2O4溶液的反应(此反应为放热反应)来探究“条件对化学反应速率的影响”,并设计了如下的方案记录实验结果(忽略溶液混合体积变化)。限选试剂和仪器:0.20 mol/L H2C2O4溶液、0.010 mol/L KMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽。
物理量 编号 | V(0.20 mol/L H2C2O4溶液)/mL | V(蒸馏水)/mL | V(0.010 mol/L酸性KMnO4溶液)/mL | m(MnSO4)/g | T/℃ | 乙 |
① | 2.0 | 0 | 4.0 | 0 | 50 | |
② | 2.0 | 0 | 4.0 | 0 | 25 | |
③ | 1.5 | a | 4.0 | 0 | 25 | |
④ | 2.0 | 0 | 4.0 | 0.1 | 25 |