
【题目】化学实验是科学探究过程中的一种重要方法,掌握化学实验的基本操作和物质的制备、转化及性质的探究尤为重要,请结合所学化学实验知识回答以下问题。某化学课外活动小组为了验证元素化学性质递变规律,进行如下实验探究。
探究:验证氯元素的非金属性比硫元素的非金属性强,设计如下实验:
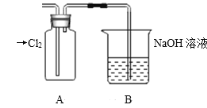
(1)装置A中盛放的试剂是____(填选项),化学反应方程式是___。
A.Na2SO3溶液 B.Na2S溶液 C.Na2SO4溶液
(2)下列不能用于验证氯元素比硫元素非金属性强的依据为______(填选项)。
①HCl的溶解度比H2S大 ②HCl的酸性比H2S强 ③HCl的稳定性比H2S大④HCl的还原性比H2S弱⑤HClO4的酸性比H2SO4强 ⑥还原性:Cl-<S2- ⑦Cl2能与H2S反应生成S ⑧在周期表中Cl处于S同周期的右侧
(3)若要验证非金属性:Cl>I,装置A中加入淀粉碘化钾混合溶液,观察到装置A中溶液_______的现象,即可证明。用元素周期律理论解释非金属性Cl>I的原因:_________。
【答案】B Cl2+Na2S=2NaCl+S↓ ①② 蓝色 Cl与I同主族,且Cl在I的上方,同主族元素,从上到下,非金属性依次减弱,则非金属性Cl>I
【解析】
(1)验证氯元素的非金属性比硫强,可通过置换反应、强酸制弱酸的反应等进行判断,装置A中盛放的试剂是Na2S溶液;
(2)①HCl的溶解度比H2S大,溶解度是物理性质,不能比较非金属性强弱;
②HCl的酸性比H2S强,氢化物酸性不能比较非金属性强弱,如HF是弱酸、HCl是强酸,但非金属性F>Cl;
③HCl的稳定性比H2S大,则表明前者共价键比后者难断裂;
④HCl的还原性比H2S弱,表明前者Cl的失电子能力比S弱,则得电子能力比S强;
⑤HClO4的酸性比H2SO4强,则非金属性Cl比S强;
⑥还原性:Cl- <S2-,表明前者Cl-的失电子能力比S2-弱,则得电子能力比S强;
⑦Cl2能与H2S反应生成S,Cl2为氧化剂,S为氧化产物,则非金属性Cl>S;
⑧在周期表中Cl处于S同周期的右侧,同周期元素,从左往右,非金属性依次增强,则非金属性Cl>S;
(3)若要验证非金属性:Cl>I,装置A中加入淀粉碘化钾混合溶液,装置A中生成I2,与淀粉发生显色反应。用元素周期律理论解释非金属性Cl>I,二者同主族,且Cl在I的上方。
(1)验证氯元素的非金属性比硫强,可通过置换反应,装置A中盛放的试剂是B;化学反应方程式为Cl2+Na2S=2NaCl+S↓;
(2)①HCl的溶解度比H2S大,溶解度是物理性质,不能比较非金属性强弱,①符合题意;
②HCl的酸性比H2S强,氢化物酸性不能比较非金属性强弱,如HF是弱酸、HCl是强酸,但非金属性F>Cl,②符合题意;
③HCl的稳定性比H2S大,则表明前者共价键比后者难断裂,从而说明Cl的非金属性比S强,③不合题意;
④HCl的还原性比H2S弱,表明前者Cl的失电子能力比S弱,则得电子能力Cl比S强,④不合题意;
⑤HClO4的酸性比H2SO4强,则非金属性Cl比S强,⑤不合题意;
⑥还原性:Cl-<S2-,表明前者Cl-的失电子能力比S2-弱,则得电子能力Cl比S强,⑥不合题意;
⑦Cl2能与H2S反应生成S,Cl2为氧化剂,S为氧化产物,则非金属性Cl>S,⑦不合题意;
⑧在周期表中Cl处于S同周期的右侧,同周期元素,从左往右,非金属性依次增强,则非金属性Cl>S,⑧不合题意。
则不能用于验证氯元素比硫元素非金属性强的依据为①②;答案为:①②;
(3)若要验证非金属性:Cl>I,装置A中加入淀粉碘化钾混合溶液,装置A中生成I2,与淀粉发生显色反应,溶液显蓝色。用元素周期律理论解释非金属性Cl>I的原因:Cl与I同主族,且Cl在I的上方,同主族元素,从上到下,非金属性依次减弱,则非金属性Cl>I。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下面是元素周期表的简略框架图。
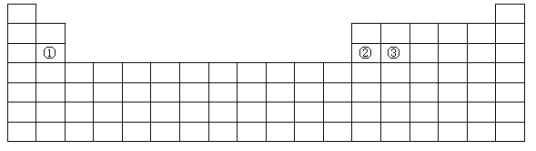
(1)在第2~5周期,处于金属元素与非金属元素分界线附近的非金属元素依次是____(填元素符号)。
(2)根据氢元素最高正价与最低负价的绝对值相等,你认为可把氢元素放在周期表中______族;有人建议将氢元素排在元素周期表的ⅦA族,请你写出支持这一观点的1个化学事实______________________。
(3)比较上表中元素①与元素②的下列性质(填写“>”或“<”)。电负性:①_____②;第一电离能:①____________②。
(4)某短周期元素最高正价为+7,其原子结构示意图为__________________。
(5)基态原子③中,电子占据的最高能层符号_____,该能层具有的原子轨道数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的装置中,若通直流电5min时,铜电极质量增加2.16g。下列说法错误的是( )
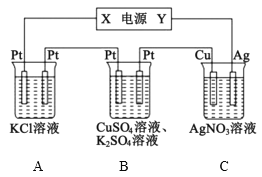
A.电源中X电极为直流电源的负极
B.pH变化:A:增大,B:减小,C:不变
C.通电5min时,B中共收集224mL(标准状况下)气体,该气体是氧气
D.若A中KCl足量且溶液的体积为200mL,则电解后,溶液的pH为13(假设电解前后溶液体积无变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所涉及的物质均为中学化学中的常见物质,其中C、D、E为单质,E为固体,F为有磁性的化合物。它们之间存在如下关系(反应中生成的水及次要产物均已略去):
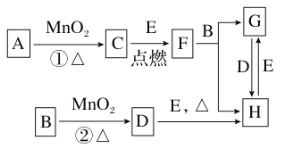
(1)写出下列物质的化学式:B________,E________。
(2)指出MnO2在相关反应中的作用:反应①中是________剂,反应②中是________剂。
(3)若反应①是在加热条件下进行,则A是________(填化学式);若反应①是在常温条件下进行,则A是________(填化学式);如在上述两种条件下得到等质量的C单质,反应中转移的电子数之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸在生活中应用广泛,H3BO3可以通过电解NaB(OH)4溶液的方法制备,其工作原理如图,a、c为阳离子交换膜,且H+可B(OH)4-与反应生成H3BO3,下列叙述错误的是( )
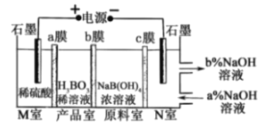
A. M室发生的电极反应式为:2H2O-4e-=O2↑+4H+
B. N室中:a%<b%
C. b膜为阴离子交换膜,产品室发生反应的化学原理为强酸制弱酸
D. 理论上每生成1mol产品,阴极室可生成标准状况下5.6L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关元素X、Y、D、E的信息如下:
元素 | 有关信息 |
X | 地壳中含量最高的元素 |
Y | 第三周期中原子半径最小的元素 |
D | 最高价氧化物既能溶于强酸又能溶于强碱 |
E | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
用化学用语回答下列问题:
(1)D在元素周期表中的位置为____。
(2)X、Y、D形成的简单离子的半径由大到小为_____。
(3)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为_________,D的单质溶于强碱的离子方程式为________。
(4)E元素与Y元素可形成EY2和EY3两种化合物,下列说法正确的是(填序号)_____。
①保存EY2溶液时,需向溶液加入少量E单质
②EY2、EY3均能通过化合反应生成
③向煮沸的NaOH溶液中滴加几滴饱和EY3溶液,可以制得胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰(CN)2、硫氰(SCN)2等称为拟卤素,它们与卤素单质性质相似,它们的阴离子也与卤素阴离子性质相似。例如:2Fe+3(SCN)2==2Fe(SCN)3、Ag++CN-== AgCN↓(白)。拟卤素形成的无氧酸和含氧酸一般比氢卤酸和次卤酸弱,阴离子的还原性一般比Br-强。下列反应中,不正确的是( )
A. 2CN-+Cl2= 2Cl-+(CN)2
B. (CN)2+2OH-=CN-+CNO-+H2O
C. (SCN)2+H2O = 2H++SCN-+SCNO-
D. MnO2+4HSCN(浓)![]() (SCN)2↑+Mn(SCN)2+2H2O
(SCN)2↑+Mn(SCN)2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E分别是铁或铁的化合物。其中D是一种红褐色沉淀。其相互反应关系如图所示:
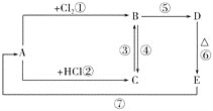
根据如图所示变化,按要求回答下列问题:
(1)写出A、E的化学式:A__,E__;
(2)写出其中几步反应的化学方程式:
C→B:___;
B→D:___;
E→A:___。
(3)C中加入NaOH溶液,看到的现象是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近期,李兰娟院士通过体外细胞实验发现抗病毒药物阿比多尔(H)能有效抑制冠状病毒,同时能显著抑制病毒对细胞的病变效应。合成阿比多尔的一条路线为:
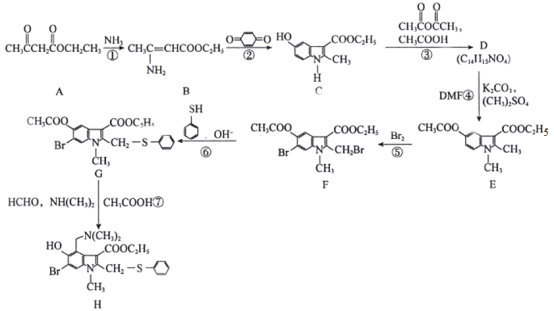
已知: 。
。
回答下列问题:
(1)阿比多尔分子中的含氧官能团为__________、____________,D的结构简式为______________。
(2)反应②的化学方程式为_______________;反应③的作用是_______________;反应⑤的类型为________________。
(3)A的同分异构体中,能发生银镜反应且能与碳酸氢钠溶液反应放出气体的有______种(不考虑立体异构)。
(4)以下为中间体D的另一条合成路线:
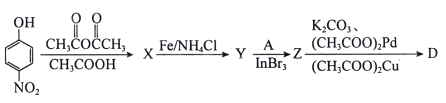
其中X、Y、Z的结构简式分别为_________、__________、_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com