
| A、在纸上层析操作时,要让试样点刚好接触展开剂,否则不能很好地分离 |
| B、实验室制备硝基苯时,先将浓硫酸滴入浓硝酸后,冷却,再边振荡边滴加苯 |
| C、从海带中提取碘的方法是:取样→灼烧→溶解→过滤→萃取 |
| D、向盛有少量Na2O2的试管中加入少量水,并立即滴入2滴酚酞,振荡,溶液呈红色 |


科目:高中化学 来源: 题型:
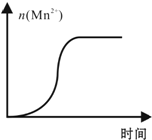 KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去.某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响.该实验条件作如下限定:
KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去.某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响.该实验条件作如下限定:| KMnO4酸性溶液浓度 (mol?L-1) | 溶液褪色所需时间(min) | ||
| 第一次 | 第二次 | 第三次 | |
| 0.02 | 14 | 13 | 11 |
| 0.002 | 6.7 | 6.6 | 6.7 |
| KMnO4酸性溶液 | H2C2O4溶液 | ||
| 浓度/mol?L-1 | 体积(mL) | 浓度/mol?L-1 | 体积(mL) |
| 0.02 | 2 | b | 4 |
| a | 2 | c | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③⑤⑥ | B、②③④⑤⑥ |
| C、②③④⑥⑦ | D、②③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2、H2、NH3的百分含量相等 |
| B、3v(N2)正=v(H2)逆 |
| C、定容容器中,气体的密度不变 |
| D、N2、H2、NH3的浓度之比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、当x≤
| ||
| B、当x≥n时,反应的离子方程式为:2Fe2++2I-+2Cl2→2Fe3++I2+4Cl- | ||
| C、当Fe2+和I-都被氧化时,x与n的关系为x>n | ||
| D、当x=n时,反应后氧化产物的物质的量为n mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| B | AgI沉淀中滴入稀KCl溶液 | 有白色沉淀出现 | 溶解度AgCl比AgI大 |
| C | 电石与饱和食盐水制得的气体直接通入溴水 | 溴水褪色 | 乙炔一定发生加成反应 |
| D | 无色溶液中滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
| A、少量二氧化碳通入NaClO溶液中:2NaClO+CO2+H2O→Na2CO3+2HClO |
| B、过量的 HCN滴入碳酸钠溶液中 HCN+Na2CO3→NaCN+NaHCO3 |
| C、结合质子能力由强到弱的顺序为:CO32->CN->HCO3->CH3COO- |
| D、常温下电离常数:Ki2(H2CO3)>Ki(C6H5OH)>Ki(HCN) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com