
【题目】25 ℃时,向10 mL 0.1 mol·L-1一元弱碱XOH溶液中逐滴滴加0.1 mol·L-1的盐酸,溶液的AG[AG=lg![]() ]变化如图所示(溶液混合时体积变化忽略不计)。下列说法不正确的是( )
]变化如图所示(溶液混合时体积变化忽略不计)。下列说法不正确的是( )
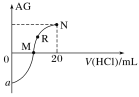
A.若a=-8,则Kb(XOH)≈10-6
B.M点表示盐酸和XOH恰好完全反应
C.R点溶液中可能存在c(X+)+c(XOH)=c(Cl-)
D.M点到N点,水的电离程度先增大后减小
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A. 乙酸乙酯与氢氧化钠溶液反应:CH3COOCH2CH3+OH→CH3COO+CH3CH2O+H2O
B. 醋酸溶液与新制氢氧化铜反应:2H++Cu(OH)2→Cu2++2H2O
C. 苯酚钠溶液中通入少量二氧化碳:2![]() +CO2+H2O
+CO2+H2O![]() 2
2![]() +CO
+CO![]()
D. 乙醛溶液与新制氢氧化铜碱性悬浊液共热CH3CHO+2Cu(OH)2+OH![]() CH3COO+ Cu2O↓+3H2O
CH3COO+ Cu2O↓+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)CuS(s)+Mn2+(aq)。下列有关叙述中正确的是
A.该反应的平衡常数K=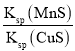
B.MnS的Ksp小于CuS的Ksp
C.达到平衡时c(Mn2+)=c(Cu2+)
D.向溶液中加入少量Na2S固体后,溶液中c(Cu2+)、c(Mn2+)保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图有机物的正确命名为 ( )

A.2-乙基-3,3-二甲基戊烷B.3,3-二甲基-4-乙基戊烷
C.3,3,4-三甲基己烷D.3,4,4-三甲基己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子并得到副产物ZnO。制备流程如图所示:(已知ZnO能溶于强碱)
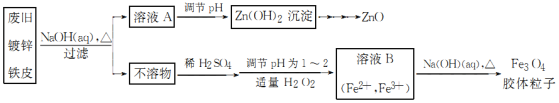
已知:Zn及其化合物的性质与Al及其化合物的性质相似。请回答下列问题:
(1)用NaOH溶液处理废旧镀锌铁皮的目的是________(填字母)。
A 去除油污 B 溶解镀锌层
C 去除铁锈 D 钝化铁皮
(2)调节溶液A的pH可产生Zn(OH)2沉淀,为制得ZnO,后续操作步骤是抽滤______。
(3)加适量H2O2 目的是________ 溶液B制得Fe3O4胶体粒子的过程中,须持续通入N2,其原因是_____。
(4)副产物ZnO常用于制备锌单质。我国早有炼锌技术的记载,明代宋应星著的《天工开物》中有“升炼倭铅”的记载:“每炉甘石十斤,装载入一泥罐内……然后逐层用煤炭饼垫盛,其底铺薪,发火煅红冷定毁罐取出…即倭铅也。”该炼锌工艺过程涉及主要反应的化学方程式为_________,(注:炉甘石的主要成分为碳酸锌,“倭铅”是指金属锌)。
(5)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.01 mol·L-1的K2Cr2O7标准溶液250 mL,应准确称取________g K2Cr2O7[保留4位有效数字,已知Mr(K2Cr2O7)=294]。配制该标准溶液时,下列仪器中用不到的有________(填编号)。
①电子天平 ②烧杯 ③量筒 ④玻璃棒 ⑤250 mL容量瓶 ⑥胶头滴管 ⑦移液管
(6)滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将________(填“偏大”“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、G是元素周期表中原子序数依次增大的五种元素。X元素是元素周期表中核电荷数最小的元素。Y的一种核素常用于考古,其一种同素异形体为自然界最硬的物质。ZX3气体溶于水呈碱性。W的外围电子排布是3s1。G2+离子的M层d轨道只有5个电子。请回答下列问题:
(1)W在元素周期表中的位置是 ;W和Z形成的化合物水溶液呈碱性,用离子方程式表示其原因 。
(2)Z原子的第一电离能比氧原子的 (填“大”或“小”);G的基态原子电子排布式是
(3)X与Y可形成多种化合物,其中一种化合物的分子式是X6Y6,分子中只有σ键,该分子的结构简式是 ;该化合物中Y的杂化轨道类型是 。
(4)G的最高价氧化物对应水化物的钾盐,在酸性条件下,常用于测定溶液中Fe2+的含量,该反应的离子方程式是
(5)可用YX4还原ZOx以消除其污染。已知:
YX4(g) +4ZO2(g)=4ZO(g)+YO2(g)+2X2O(g) △H=" -" 574 kJ·mol-1
YX4(g)+4ZO(g)=2Z2(g)十YO2(g) +2X2O(g) △H =" -1160" kJ·mol-1
试写出用YX4还原ZO2至Z2的热化学方程式___ _。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属Co、Ni性质相似,在电子工业以及金属材料上应用十分广泛.现以含钴、镍、铝的废渣(含主要成分为CoO、Co2O3、Ni、少量杂质Al2O3)提取钴、镍的工艺如下:
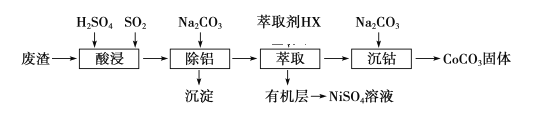
(1)酸浸时SO2的作用是___________________________________。
(2)除铝时加入碳酸钠产生沉淀的离子反应_________________________________。
(3)用CoCO3为原料采用微波水热法和常规水热法均可制得H2O2分解的高效催化剂CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价).如图是用两种不同方法制得的CoxNi(1-x)Fe2O4 在10℃时催化分解6%的H2O2 溶液的相对初始速率随x 变化曲线.
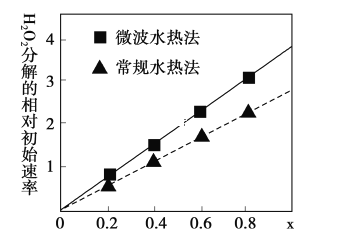
①H2O2 的电子式_________________________________。
②由图中信息可知:_________________________________法制取的催化剂活性更高。
③Co2+ 、Ni2+ 两种离子中催化效果更好的是_________________________________。
(4)已知煅烧CoCO3时,温度不同,产物不同.在400℃充分煅烧CoCO3,得到固体氧化物的质量2.41g,CO2的体积为0.672L(标况下),则此时所得固体氧化物的化学式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知AgCl在水中的溶解是吸热过程。不同温度下,AgCl在水中的沉淀溶解平衡曲线如图所示。己知T1温度下Ksp(AgCl)=1.6×10-9,下列说法正确的是
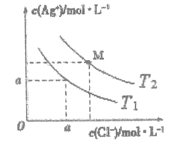
A. T1>T2
B. a =4.0×10-5
C. M点溶液温度变为T1时,溶液中Cl-的浓度不变
D. T2时饱和AgCl溶液中,c(Ag+)、c(Cl-)可能分别为2.0×10-5mol/L、4.0×10-5mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com