
【题目】生产生活中广泛涉及氧化还原反应
Ⅰ.研究电化学腐蚀及防护的装置如图所示
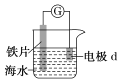
(1)若d为石墨,石墨上的电极反应式为_________________ ;
(2)若d为锌,锌上的电极反应式为___________________;
(3)将图中电流表换成外接电源,铁片接___________(填“正”或“负”)极被保护
Ⅱ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钾的主要反应为:2FeSO4+ 6Na2O2![]() 2Na2FeO4+2Na2O+2Na2SO4+O2↑
2Na2FeO4+2Na2O+2Na2SO4+O2↑
①该反应中的氧化剂是________________,还原剂是_______________,每生成1 molNa2FeO4转移_______mol电子。
②简要说明K2FeO4作为水处理剂时所起的作用_________________________________
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①写出并配平湿法制高铁酸钾反应的离子方程式:____________________________。
②每生成1 mol FeO42-转移________mol电子,若反应过程中转移了0.3 mol电子,则还原产物的物质的量为________mol。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明什么问题______。
【答案】O2+4e﹣+2H2O=4OH-Zn- 2e﹣= Zn2+负Na2O2Na2O2和FeSO45高铁酸钾具有强氧化性,能杀菌消毒;消毒过程中自身被还原为Fe3+,Fe3+水解生成Fe(OH)3胶体能吸附水中悬浮杂质而沉降2Fe(OH)3+ 3ClO-+ 4OH-=2FeO42—+3Cl-+ 5H2O30.15 mol该温度下K2FeO4比Na2FeO4的溶解度小
【解析】
Ⅰ(1)活泼金属铁片作负极,发生腐蚀,d为石墨,做正极,因为海水为中性,溶解在海水溶液中的氧气得电子,极反应为:O2+4e﹣+2H2O=4OH-;正确答案:O2+4e﹣+2H2O=4OH-。
(2)若d为锌,锌比铁活泼,锌做负极,发生氧化反应,极反应为:Zn- 2e﹣= Zn2+;正确答案:Zn- 2e﹣= Zn2+。
(3)将图中电流表换成外接电源,铁片接电源的负极,做电解池的阴极,不失电子,铁被保护;正确答案:负。
Ⅱ. (1)①反应中Fe元素化合价由+2价升高为+6价,被氧化,FeSO4为还原剂,过氧化钠中O元素的化合价由-1价降低为-2价,由-1价升高为0,过氧化钠既是氧化剂也是还原剂,由方程式可以知道,生成2molNa2FeO4,有6molNa2O2参加反应,转移10mol电子,则每生成1molNa2FeO4转移的电子数为5mol;因此,本题正确答案是:Na2O2;FeSO4和Na2O2;5。
②高铁酸钾具有强氧化性,能杀菌消毒;消毒过程中自身被还原为Fe3+,Fe3+水解生成Fe(OH)3胶体能吸附水中悬浮杂质而沉降;正确答案:高铁酸钾具有强氧化性,能杀菌消毒;消毒过程中自身被还原为Fe3+,Fe3+水解生成Fe(OH)3胶体能吸附水中悬浮杂质而沉降。
(2)①湿法制备高铁酸钾(K2FeO4)时,Fe(OH)3失电子被氧化生成K2FeO4,Fe的化合价升高了3价,C1O-作氧化剂被还原生成C1-,氯元素的价态降了2价,根据电子守恒,得到铁元素物质前边系数是2,Cl的前边系数是3,氢氧化铁必须在碱性条件下存在,所以该反应是在碱性条件下进行,该离子反应为2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O;因此,本题正确答案是:2Fe(OH)3+ 3ClO-+ 4OH-=2FeO42—+3Cl-+ 5H2O。
②反应2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O中转移电子是6mol,生成2molFeO42-,每生成1molFeO42-转移3mol电子;若反应过程中转移了0.3mol电子,则还原产物氯离子的物质的量为0.15mol,因此,本题正确答案是:3;0.15mol。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),在溶液中发生了离子的交换使物质的溶解性发生了改变,可能的原因是该温度下K2FeO4的溶解度比Na2FeO4的溶解度小;正确答案:该温度下K2FeO4比Na2FeO4的溶解度小。


科目:高中化学 来源: 题型:
【题目】足量的铜和含有2.4×10-3mol 硝酸的某浓硝酸完全反应,共收集到标准状况下气体的体积是22.4 mL。参加反应的铜的物质的量是( )
A. 0.6×10-3 molB. 0.7×10-3 mol
C. 0.75×10-3 molD. 0.9×10-3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)标准状况下,1.92 g某气体的体积为672 mL,则此气体的相对分子质量为_____。
(2)在25 ℃、101 kPa的条件下,同质量的CH4和A气体的体积之比是15∶8,则A的摩尔质量为________________。
(3)两个相同容积的密闭容器X、Y,在25 ℃下,X中充入a g A气体,Y中充入a g CH4气体,X与Y内的压强之比是4∶11,则A的摩尔质量为_____________。
(4)19 g某二价金属的氯化物RCl2中含有0.4 mol的Cl-,则R的相对原子质量为__________。
(5)V L Fe2(SO4)3溶液中含Fe3+ m g,则溶液中SO42-的物质的量浓度为___________mol·L-1。
(6)在无土栽培中,配制1 L含5 mol NH4Cl、1.6 mol KCl、2.4 mol K2SO4的某营养液,若用KCl、NH4Cl、(NH4)2SO4配制,则需KCl、NH4Cl的物质的量分别为________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、X是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。
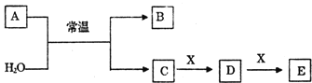
(1)若A为常见的金属单质,焰色反应呈黄色,X能使品红溶液褪色,写出C和E反应的离子方程式________________________________________。
(2)若A为电石(CaC2),X为深红棕色液体非金属单质,写出D + X → E反应的化学方程式为________________________________ 。
(3)若A为淡黄色粉末,回答下列问题:
①A与H2O反应的离子方程式为__________________________________ 。
②若X为非金属单质,通常为黑色粉末,写出D的结构式为______________。
③若X为一种造成温室效应的气体.则鉴别等浓度的D、E两种溶液,可选择的试剂为_________。
a.盐酸 b.BaCl2溶液 c.NaOH溶液 d.Ca(OH)2溶液
(4)若A为氧化物,X为常见的金属单质,在溶液D中滴加KSCN溶液会变红色。
①A与H2O反应的化学反应方程式为__________________________________ 。
②指明X 在元素周期表中位置为________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 瘦肉精学名盐酸克伦特罗,结构如右图,可以发生取代、加成、水解、酯化、消去反应

B. C3H7OH与C4H9OH分子间脱水,最多可生成6种醚
C. 1mol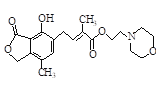 最多可与含4mol NaOH的水溶液完全反应
最多可与含4mol NaOH的水溶液完全反应
D. 某油脂的化学式为 ,它既属于酯类又属于高分子化合物
,它既属于酯类又属于高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大报告提出将我国建设成为制造强国,2020年我国“PX”产能将达到3496万吨/年。有机物(烃)“PX”的结构模型如下图,下列说法错误的是

A. “PX”的分子式为C8H10
B. “PX”的二氯代物共有6种(不考虑立体异构)
C. “PX”分子中,最多有14个原子共面
D. 可用酸性KMnO4溶液鉴别“PX”与苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。已知:2KMnO4+16HCl―→2KCl+5Cl2↑+2MnCl2+8H2O

对实验现象的“解释或结论”正确的是 ( )
选项 | 实验现象 | 解释或结论 |
A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
C | d处立即褪色 | 氯气与水生成了漂白性物质 |
D | e处变红色 | 还原性:Fe2+>Cl- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X和Y的原子序数都小于18,两者能组成化合物X2Y3,已知X的原子序数为n,则Y的原子序数不可能是( )
A. n+11 B. n-5 C. n+3 D. n-6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com