
【题目】生活中的有机物种类丰富,在衣食住行多方面应用广泛,其中乙醇是较常见的有机物,它在人体内的主要代谢途径为如下:![]()
乙酸彻底氧化形成H2O、CO2同时释放出大量ATP。乙醇及其代谢产物部分对人体会造成伤害,所以青少年禁止饮酒。
(1)CH3CH2OH的官能团是__________(填“羟基”或“羧基”);
(2)乙醇在人体内的第一步代谢反应:2CH3CH2OH+O2![]() 2CH3CHO+2H2O ,该反应的类型是_________(填“氧化反应”或“取代反应”);
2CH3CHO+2H2O ,该反应的类型是_________(填“氧化反应”或“取代反应”);
(3)代谢过程中涉及到的CH3CHO、CH3COOH_________(填“易”或“难”)溶于水。
科目:高中化学 来源: 题型:
【题目】已知0.1 mol·L-1的氢氟酸溶液中存在电离平衡:HF![]() F-+H+,要使溶液中
F-+H+,要使溶液中![]() 的值增大,可以采取的措施是( )
的值增大,可以采取的措施是( )
①加少量烧碱溶液 ②升高温度 ③通入少量HF气体 ④加水
A.①②B.①③C.②④D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为![]() 。下列有关说法错误的是
。下列有关说法错误的是
A. 该有机物的分子式为C10H10O2
B. 该有机物能发生加成反应、取代反应、氧化反应
C. 该有机物分子中所有碳原子可能共平面
D. 该有机物能使酸性高锰酸钾溶液和溴水褪色,其褪色原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂。实验室利用FeCO3与甘氨酸(NH2CH2COOH)制备甘氨酸亚铁,实验装置如下图所示(夹持和加热仪器已省略)。
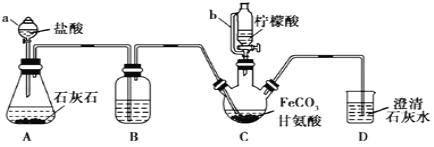
查阅资料已知:①甘氨酸易溶于水,微溶于乙醇;甘氨酸亚铁易溶于水,难溶于乙醇。
②柠檬酸易溶于水和乙醇,具有较强的还原性和酸性。实验过程如下:
I.装置C中盛有17.4gFeCO3和200mL1.0mol·L-1甘氨酸溶液。实验时,先打开仪器a的活塞,待装置c中空气排净后,加热并不断搅拌;然后向三颈瓶中滴加柠檬酸溶液。
Ⅱ.反应结束后过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
(1)仪器a的名称是_________;与a相比,仪器b的优点是_________。
(2)装置B中盛有的试剂是:________;
(3)向FeSO4溶液中加入NH4HCO3溶液可制得FeCO3,该反应的离子方程式为_____。
(4)过程I加入柠檬酸促进FeCO3溶解并调节溶液pH,柠檬酸的作用还有________。
(5)过程II中加入无水乙醇的目的是_________。
(6)本实验制得15.3g甘氨酸亚铁,则其产率是________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某甲烷燃料电池构造示意图如下,关于该电池的说法不正确的是

A. 电解质溶液中Na+向b极移动
B. b极的电极反应是:O2+2H2O+4e-=4OH-
C. a极是负极,发生氧化反应
D. 电子通过外电路从b电极流向a电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠![]() 是一种高效的漂白剂和消毒剂,它在酸性条件下生成NaCl并放出
是一种高效的漂白剂和消毒剂,它在酸性条件下生成NaCl并放出![]() ,
,![]() 有类似
有类似![]() 的性质。某兴趣小组探究亚氯酸钠的制备与性质。
的性质。某兴趣小组探究亚氯酸钠的制备与性质。
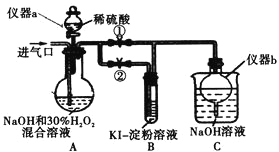
(I)制备亚氯酸钠
关闭止水夹![]() ,打开止水夹
,打开止水夹![]() ,从进气口通入足量
,从进气口通入足量![]() ,充分反应。
,充分反应。
(1)仪器a的名称为_________,仪器b的作用是_________。
(2)装置A中生成![]() 的化学方程式为_________。
的化学方程式为_________。
(3)若从装置A反应后的溶液中获得![]() 晶体,则主要操作有:减压蒸发浓缩、________、过滤、洗涤、干燥等。
晶体,则主要操作有:减压蒸发浓缩、________、过滤、洗涤、干燥等。
(II)探究亚氯酸钠的性质
停止通![]() 气体,再通入空气一段时间后,关闭止水夹
气体,再通入空气一段时间后,关闭止水夹![]() ,打开止水夹
,打开止水夹![]() ,向A中滴入稀硫酸。
,向A中滴入稀硫酸。
(4)请写出这时A中发生反应的离子方程式_________。
(5)开始时A中反应缓慢,稍后产生气体的速率急剧加快,请解释可能的原因_________。
(6)B中现象为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列各组物质:①金刚石和C60 ②H、D和T ③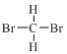 和
和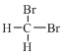 ④CH3(CH2)2CH3和(CH3)2CHCH3 ⑤正戊烷和异戊烷 ⑥(CH3)3CCH2CH2CH3和CH3CH2CH2CH2CH3 ⑦H2O、T2O和D2O。互为同位素的是(填序号,下同)___,互为同素异形体的是______,互为同系物的是_____,属于同分异构体的是_______。
④CH3(CH2)2CH3和(CH3)2CHCH3 ⑤正戊烷和异戊烷 ⑥(CH3)3CCH2CH2CH3和CH3CH2CH2CH2CH3 ⑦H2O、T2O和D2O。互为同位素的是(填序号,下同)___,互为同素异形体的是______,互为同系物的是_____,属于同分异构体的是_______。
(2)①下列分子式仅能表示一种物质的是___________(填序号);
A.C2H4O2 B.C4H8 C.C2H5Cl
②已知C4H9Cl共有四种结构,则分子式为C5H10O的醛应有____________种;
③某有机物的分子式为C3H6O3,其分子结构中含有羧基和羟基,但没有甲基,则该有机物的结构式为 ______。
(3)A~D四种物质皆为烃类有机物,分子球棍模型分别如图所示,请回答下列问题。
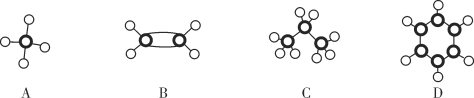
①等物质的量的上述烃,完全燃烧时消耗O2最多的是__________(填字母代号,下同),等质量的上述烃完全燃烧时消耗O2最多的是________。
②在120℃,1.01×105Pa下,A和C分别与足量O2混合点燃,完全燃烧后气体体积没有变化的是________________。
③B的某种同系物W,分子式为C6H12,且所有碳原子都在同一平面上,则W的结构简式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
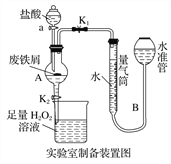
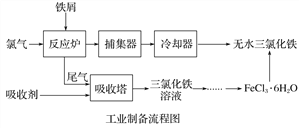
【题目】氯化铁是常见的水处理剂,利用废铁屑可制备无水氯化铁。实验室制备装置和工业制备流程图如下:
已知:(1)无水FeCl3的熔点为555 K、沸点为588 K。
(2)废铁屑中的杂质不与盐酸反应。
(3)不同温度下六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 20 | 80 | 100 |
溶解度(g/100 g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
实验室制备操作步骤如下:
Ⅰ.打开弹簧夹K1,关闭活塞K2,并打开活塞a,缓慢滴加盐酸;
Ⅱ.当……时,关闭弹簧夹K1,打开活塞K2,当A中溶液完全进入烧杯后关闭活塞a;
Ⅲ.将烧杯中溶液经过一系列操作后得到FeCl3·6H2O晶体。
请回答:
(1)烧杯中足量的H2O2溶液的作用是_____________________________。
(2)为了测定废铁屑中铁的质量分数,操作Ⅱ中“…”的内容是______________。
(3)从FeCl3溶液制得FeCl3·6H2O晶体的操作步骤是加入______________后__________________、过滤、洗涤、干燥。
(4)试写出吸收塔中反应的离子方程式:______________________。
(5)捕集器温度超过673 K时,存在相对分子质量为325的铁的氯化物,该物质的分子式(相对原子质量:Cl-35.5、Fe-56)为____________。
(6)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,配制成100 mL溶液;取出10.00 mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用c mol·L-1 Na2S2O3溶液滴定,消耗V mL(已知:I2+2S2O32-=2I-+S4O62-)。
①滴定终点的现象是________________________________________________;
②样品中氯化铁的质量分数为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
A.化学反应能够制造新物质,同时也能制造出新的元素
B.煤在空气中强热得到焦炭、煤焦油、焦炉气、粗氨水等产物的过程叫煤的干馏
C.在酿酒的过程中,葡萄糖可通过水解反应生成酒精
D.工业生产玻璃、水泥、冶炼铁均需要用到石灰石为原料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com