
【题目】甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂。实验室利用FeCO3与甘氨酸(NH2CH2COOH)制备甘氨酸亚铁,实验装置如下图所示(夹持和加热仪器已省略)。
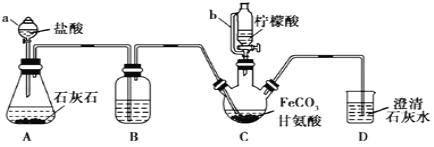
查阅资料已知:①甘氨酸易溶于水,微溶于乙醇;甘氨酸亚铁易溶于水,难溶于乙醇。
②柠檬酸易溶于水和乙醇,具有较强的还原性和酸性。实验过程如下:
I.装置C中盛有17.4gFeCO3和200mL1.0mol·L-1甘氨酸溶液。实验时,先打开仪器a的活塞,待装置c中空气排净后,加热并不断搅拌;然后向三颈瓶中滴加柠檬酸溶液。
Ⅱ.反应结束后过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
(1)仪器a的名称是_________;与a相比,仪器b的优点是_________。
(2)装置B中盛有的试剂是:________;
(3)向FeSO4溶液中加入NH4HCO3溶液可制得FeCO3,该反应的离子方程式为_____。
(4)过程I加入柠檬酸促进FeCO3溶解并调节溶液pH,柠檬酸的作用还有________。
(5)过程II中加入无水乙醇的目的是_________。
(6)本实验制得15.3g甘氨酸亚铁,则其产率是________%。
【答案】分液漏斗 平衡压强、便于液体顺利流下 饱和NaHCO3溶液 Fe2++2HCO3-=FeCO3↓+CO2↑+H2O 防止Fe2+被氧化 降低甘氨酸亚铁的溶解度,使其结晶析出 75
【解析】
根据装置:A制备二氧化碳,B装置除去二氧化碳中的HCl,C装置制备甘氨酸亚铁,D装置检验装置内空气是否排尽,防止空气进入装置C。
(1)根据仪器构造和作用分析;
(2)根据装置B的作用分析;亚铁易被氧化,故装置为无氧环境,据此分析;
(3)向FeSO4溶液中加入NH4HCO3溶液可制得FeCO3,同时生成二氧化碳和水,据此书写;
(4)①pH过低,NH2CH2COOH反应,pH过高,Fe2+沉淀;
②根据已知中柠檬酸具有较强的还原性分析;
(5)已知:甘氨酸亚铁易溶于水,难溶于乙醇,据此分析;
(6)17.4gFeCO3物质的量为0.15mol,200mL1.0mol/L甘氨酸为0.2mol,根据FeCO3+2NH2CH2COOH=(NH2CH2COO)2Fe+CO2↑+H2O,则FeCO3过量,故理论上生成的(NH2CH2COO)2Fe的物质的量为![]() n(NH2CH2COOH)=0.1mol,据此计算。
n(NH2CH2COOH)=0.1mol,据此计算。
(1)根据仪器结构可知:仪器a为分液漏斗,仪器b为滴液漏斗,滴液漏斗的优点是:能平衡压强,便于液体顺利滴下;
(2)应用盐酸具有挥发性,实验装置A制得的二氧化碳混有HCl气体,B装置除去CO2中混有杂质HCl,而不溶解CO2,故装置B中试剂为饱和NaHCO3溶液;
(3)向FeSO4溶液中加入NH4HCO3溶液可制得FeCO3,同时生成CO2和H2O,反应的离子方程式为:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;
(4)柠檬酸易溶于水和乙醇,具有较强的还原性和酸性,加入柠檬酸促进FeCO3溶解并调节溶液pH,同时还可以防止Fe2+被氧化;
(5)已知:甘氨酸亚铁易溶于水,难溶于乙醇,所以加入无水乙醇可以降低甘氨酸亚铁的溶解度,使其结晶析出;
(6)17.4gFeCO3物质的量为n(FeCO3)=17.4g÷116g/mol=0.15mol,200mL1.0mol/L甘氨酸为0.2mol,根据FeCO3+2NH2CH2COOH=(NH2CH2COO)2Fe+CO2↑+H2O,则FeCO3过量,故根据甘氨酸进行计算,则理论上生成的(NH2CH2COO)2Fe的物质的量n[(NH2CH2COO)2Fe]=![]() n(NH2CH2COOH)=0.1mol,故产率为
n(NH2CH2COOH)=0.1mol,故产率为![]() ×100%=75%。
×100%=75%。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如图表示吸热反应、置换反应、氧化还原反应之间的关系,从下列选项反应中选出属于区域V的是( )
![]()
A.Na2O2+2CO2=Na2CO3+O2B.NaOH+HCl=NaCl+H2O
C.2NaHO3=2Na2CO3+H2O+CO2↑D.2Na+2H2O=NaOH+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院科研团队研究发现,在常温常压和可见光下,基于 LDH(一种固体催化剂)合成NH3的原理示意图如图所示。下列说法不正确的是( )
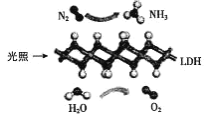
A.该反应属于置换反应
B.该过程中只涉及极性键的断裂与生成
C.基于 LDH 合成 NH3的过程属于氮的固定
D.该过程中每生成 2.24L(标准状况)O2则转移 0.4mol 电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于铝热反应2Al+Fe2O3![]() 2Fe+Al2O3的说法正确的是( )
2Fe+Al2O3的说法正确的是( )
A.Al发生氧化反应B.Fe2O3被氧化
C.Fe是还原剂D.Al2O3是氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用100mL0.50mol/LNaOH溶液与60mL0.50mol/L硫酸进行中和热的测定。装置如图所示,回答下列问题:
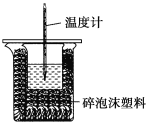
(1)若实验共需要400mLNaOH溶液,实验室在配制该溶液时,则需要称量NaOH固体____g。
(2)图中装置缺少的仪器是____。
(3)硫酸稍过量的原因是____。
(4)请填写下表中的平均温度差:
实验 次数 | 起始温度T1/℃ | 终止温度 T2/℃ | 平均温度差 (T2-T1)/℃ | ||
HCl | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ____ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
(5)近似认为0.50 mol/L NaOH溶液与0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容为c=4.18J/(g℃)则上述实验中和热ΔH=___(取小数点后一位)
(6)上述实验结果与57.3kJ/mol有偏差产生偏差的原因可能是____
A.量取NaOH溶液时仰视读数
B.为了使反应充分,可以向酸中分次加入碱
C.实验装置保温隔热效果差
D.用铜丝代替玻璃棒搅拌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的恒容容器中,充入1molA和3molB,并在一定条件下发生反应:A(g)+3B(g)![]() 2C(g);经3s后达到平衡,测得C气体的浓度为0.6 mol·L-1,下列说法中不正确的是( )
2C(g);经3s后达到平衡,测得C气体的浓度为0.6 mol·L-1,下列说法中不正确的是( )
A. 用B表示反应速率为0.3 mol·L-1·s-1
B. 平衡后,向容器中充入无关气体(如Ne),反应速率增大
C. 3s时生成C的物质的量为1.2mol
D. 平衡后,v(正)(A)=v(逆)(A)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中的有机物种类丰富,在衣食住行多方面应用广泛,其中乙醇是较常见的有机物,它在人体内的主要代谢途径为如下:![]()
乙酸彻底氧化形成H2O、CO2同时释放出大量ATP。乙醇及其代谢产物部分对人体会造成伤害,所以青少年禁止饮酒。
(1)CH3CH2OH的官能团是__________(填“羟基”或“羧基”);
(2)乙醇在人体内的第一步代谢反应:2CH3CH2OH+O2![]() 2CH3CHO+2H2O ,该反应的类型是_________(填“氧化反应”或“取代反应”);
2CH3CHO+2H2O ,该反应的类型是_________(填“氧化反应”或“取代反应”);
(3)代谢过程中涉及到的CH3CHO、CH3COOH_________(填“易”或“难”)溶于水。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用铁丝、硫酸铜废液(含硫酸亚铁)和被有机物污染的废铜粉制备硫酸铜晶体(CuSO45H2O):

下列说法不正确的是
A.步骤①主要是利用铁丝把铜从溶液中还原出来
B.步骤②灼烧固体所用的仪器可以是坩埚
C.步骤③酸溶所用的酸是稀硫酸
D.浓硫酸可使硫酸铜晶体脱去结晶水,浓硫酸表现出脱水性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.2L由NaCl、MgCl2、CaCl2组成的混合溶液中,部分离子浓度大小如图所示,回答下列问题:

(1)该混合液中,NaCl的物质的量为_____mol,含溶质MgCl2的质量为_____g。
(2)该混合液中CaCl2的物质的量为_______mol,将该混合液加水稀释至体积为1L,稀释后溶液中Ca2+的物质的量浓度为______mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com