
【题目】高铁酸(H2FeCO4)是一种多功能、高效无毒的新型绿色水处理剂,投入水中会迅速发生反应。
(1)Na2FeO4中Fe的化合价为。.
(2)已知:常温下高铁酸为紫黑色固体,将H2FeO4投入水中,有气体生成,同时有红褐色沉淀产生,则H2FeO4与水反应的化学方程式为。
(3)在工业上制备Na2FeO4的方法有多种。
Ⅰ.干法制备的反应原理如下:
2FeSO4+6Na2O2=aNa2FeO4+M↑+2Na2O+2Na2SO4
①a=。
②每生成1mol M,该反应转移电子的物质的量为mol。
Ⅱ.湿法制备的工艺流程如下: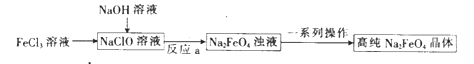
己知:Na2FeO4在强碱性溶液中的溶解度较小。
③反应a中,生成物除了Na2FeO4外,另一种盐的化学式为 。
④一系列操作包括过滤、、。
【答案】
(1)+6
(2)4H2FeO4+2H2O=4Fe(OH)3+3O2↑
(3)2,10,NaCl,洗涤,(低温)干燥
【解析】本题主要考查高铁酸钠的性质和制法。
(1)根据化合价代数和为零的原则,由钠元素+1价和氧元素-2价得到Na2FeO4中Fe的化合价为+6。
(2)生成物中气体为氧气,红褐色沉淀为氢氧化铁,则H2FeO4与水反应的化学方程式为4H2FeO4+2H2O=4Fe(OH)3+3O2↑。
(3)Ⅰ.①M气体不含有钠元素,由钠元素守恒可得a=2。
②M~10e-,每生成1molM,该反应转移电子的物质的量为10mol。
Ⅱ.③反应a中,生成物除了Na2FeO4外,另一种盐的化学式为NaCl。
④一系列操作包括过滤、洗涤、(低温)干燥。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案科目:高中化学 来源: 题型:
【题目】常温下,0.1mol·L-1的H2A溶液中各种微粒浓度的对数值(lgc)与pH的关系如图所示。( )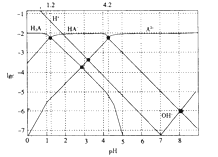
下列说法不正确的是
A.H2A是二元弱酸
B.HA-![]() H++A2-的电离平衡常数Ka=10-12
H++A2-的电离平衡常数Ka=10-12
C.0.1mol·L-1的H2A溶液中:c(H+)=c(HA-)+2c(A2-)+c(OH-)
D.pH=4.2 时:c(HA-)=c(A2-)>c(H+)>c(H2A)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废碱渣(主要成分为Na2CO3)处理硫酸厂尾气中的SO2 , 可制得无水Na2SO3(成品),其流程如图所示。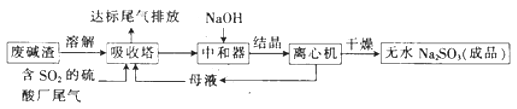
(1)某硫酸厂排放出的尾气中SO2的含量特别髙,而废碱渣的量不足,此时“吸收塔”内发生反应的离子方程式为(不考虑H2O与SO2反应)。
(2)亚硫酸钠的溶解度曲线如图所示,则上述流程中“结晶”的方法是(填“蒸发结晶”或“降温结晶”),图中a点所示分散系类别为(填“浊液”“胶体”或“溶液”)。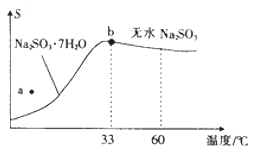
(3)仅用BaCl2、H2O2和过量稀盐酸的混合溶液难以检出“成品”中的SO32- , 原因是“成品”中含有某种杂质阴离子。
①该杂质阴离子为(填离子符号)。
②25℃时,部分钡盐的Ksp如下表所示。
化学式 | BaSO4 | BaSO3 |
Ksp | 1.1×10-10 | 5.5×10-7 |
将得到的“成品”溶于水,测得溶液中SO32-的浓度为0.5mol L-1 , 为杂质阴离子浓度的10倍,向该溶液中加入等体积、0.5mol·L-1的BaCl2溶液,充分反应后c(Ba2+)=mol L-1。(混合时溶液体积的变化忽略不计)
(4)某同学采用如下方法检验SO32-:![]()
①洗涤时使用的试剂最好为(填字母)。
a.稀HNO3 b.蒸馏水 c.稀H2SO4
②根据上述流程中的数据(w、x、y) (填“能”或“不能”)计算出成品试样中SO32-的百分含量,若能,则SO32-的百分含量为(若不能,则此空不填);若不能,则理由是(若能,则此空不填)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用右图所示装置进行下列实验,能得到相应实验结论的是 ( )
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓硫酸 | Na2SO3 | KMnO4溶液褪色 | SO2有漂白性 | |
B | 浓盐酸 | KMnO4 | FeBr2溶液变为黄色 | 氧化性:Cl2 >Br2 | |
C | 稀硫酸 | 碳酸钠 | CaCl2溶液无明显变化 | CO2不与CaCl2反应 | |
D | 浓硫酸 | 蔗糖 | 溴水褪色 | 浓硫酸具有脱水性、吸水性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。
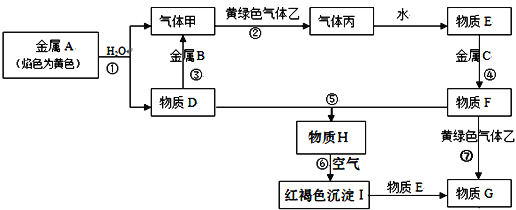
请回答下列问题:
(1)写出下列物质的化学式:B_________,丙_________,乙_________,H_________
(2)根据要求回答:
1)D溶液和F溶液在空气中混合的现象:_________________________________;
2)反应③离子方程式___________________________________________________;
3)反应⑦离子方程式___________________________________________________;
4)反应⑥化学方程式___________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com