
【题目】将V L HCl气体(标准状况),溶解在1 L水(水的密度为1 g/cm3)中,形成饱和溶液,所得溶液的密度为ρ g/mL,质量分数为ω,物质的量浓度为c mol/L,溶解度为s g,下列关系式不正确的是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
科目:高中化学 来源: 题型:
【题目】现用18.4 mol/L的浓![]() 来配制500 mL 0.2 mol/L的稀
来配制500 mL 0.2 mol/L的稀![]() 。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥托盘天平 ⑦药匙。请回答下列问题:
。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥托盘天平 ⑦药匙。请回答下列问题:
(1)上述仪器中,在配制稀![]() 时不需要使用的有________________(填代号),还缺少的仪器是________________。
时不需要使用的有________________(填代号),还缺少的仪器是________________。
(2)经计算,需浓![]() 的体积为________,量取浓硫酸时应选用________(选填①10 mL、②50 mL、③100 mL三种规格)的量筒。
的体积为________,量取浓硫酸时应选用________(选填①10 mL、②50 mL、③100 mL三种规格)的量筒。
(3)配制一定物质的量浓度NaOH溶液的实验中,如果出现以下操作:
A.称量用了生锈的砝码; B.将NaOH放在纸张上称量;
C.定容时仰视刻度线 D.往容量瓶转移时,有少量液体溅出
E.未洗涤溶解NaOH的烧杯 F.容量瓶未干燥即用来配制溶液
G.定容后塞上瓶塞反复摇匀,静置后液面不到刻度线,未加水至刻度线。
H.未冷却至室温就进行定容 I.定容时有少量水洒在容量瓶外
对配制的溶液物质的量浓度大小可能造成的影响是(填写字母)偏大的有_________;偏小的有__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表达式中正确的是( )
A. 向氯化钙溶液中通入CO2:CaCl2+CO2+H2O=CaCO3↓+2HCl
B. 铁跟盐酸反应:Fe+2HCl=FeCl2+H2↑
C. NaHCO3溶液的电离方程式:NaHCO3=Na++H+ +CO32-
D. 向沸水中滴加 FeCl3 溶液制备Fe(OH)3 胶体:FeCl3+3H2O=Fe(OH)3↓+3HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 常温下醋酸分子不可能存在于pH>7的碱性溶液中
B. 常温下pH=2的H2SO4与pH=13的NaOH溶液混和,所得混和液的pH=11,则H2SO4溶液与NaOH溶液的体积比是9:1
C. 0.1mol/L硫化钠溶液中,c(S2-)+c(HS-)+2c(H2S)=0.1mol/L
D. 常温下向氯化铵溶液中加入少量氨水使溶液的pH=7,则混合溶液中c(NH4+)>c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列有关图象,说法正确的是

A. 由图Ⅰ知,该反应的△H>0 B. 由图Ⅱ知,该反应为放热反应
C. 由图Ⅲ知,t3时一定是采取降低反应温度的措施 D. 由图Ⅲ知,反应在t6时,NH3体积分数最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一般较强酸可制取较弱酸,这是复分解反应的规律之一。已知20℃时:K(C6H5OH)=1.2×10-10、K(CH3COOH)=1.8×10-5、K(H2CO3)=4.3×10-7、K(HCO3-)=5.6×10-11、K(HCN)=4.9×10-10。
(1)请根据上述信息求Na2CO3+C6H5OH![]() NaHCO3+C6H5ONa的化学平衡常数K=__________;
NaHCO3+C6H5ONa的化学平衡常数K=__________;
(2)常温下某电解质溶解在水中后,溶液中的c(H+)=10-9molL-1,则该电解质可能是_________(填序号);
A.CuSO4 B.HCl C.Na2S D.NaOH E.K2SO4
(3)常温下,将pH=3的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性。①浓度为1.0×l0-3mol·L-1的氨水b L;②c(OH-)=1.0×10-3mol·L-1的氨水c L;③c(OH-)=1.0×10-3molL-1的氢氧化钡溶液d L。则a、b、c、d之间由大到小的关系是_________;
(4)室温时,向0.2molL-1的醋酸溶液中加入等体积的0.1molL-1的NaOH(aq),充分反应后所得溶液的pH=4,则所得溶液中各离子浓度大小关系是________________,所得溶液中的物料守恒式为:________+________=__________=_________ molL-1,所得溶液中c(CH3COOH)=____________________molL-1(写出算式,不做计算);
(5)已知常温时Ksp(AgCl)=1.8×10-10mol2L-2,向50mL 0.018molL-1的AgNO3溶液中加入相同体积0.020molL-1的盐酸,则c(Ag+)=_______________,此时所得混合溶液的pH=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用氢氧化钠固体配制0.5mol·L-1的NaOH溶液490mL,有以下仪器:①烧杯 ②100 mL量筒 ③1000 mL 容量瓶 ④500 mL 容量瓶 ⑤玻璃棒 ⑥托盘天平(带砝码)
(1)计算需要的氢氧化钠的质量为_______;
(2)配制时,必须使用的仪器有_______(填代号),还缺少的仪器是______,该实验中玻璃棒有两种用途,请说出其中一种用途_______。
(3)下列配制的溶液浓度偏低的是_______;
a.配制前,容量瓶中有少量蒸馏水
b.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面
c.加蒸馏水时不慎超过了刻度线
d.定容时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有七种元素,其中A,B,C,D,E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
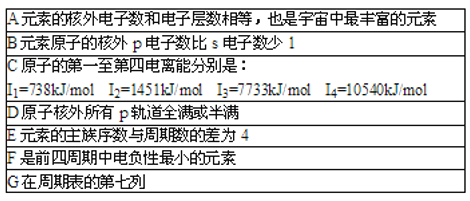
(1)已知BA5为离子化合物,写出其电子式__;
(2)B基态原子中能量最高的电子,其电子云在空间有_个方向,原子轨道呈_____形;
(3)某同学根据上述信息,推断C基态原子的核外电子排布为![]() 该同学所画的电子排布图违背了__;
该同学所画的电子排布图违背了__;
(4)G位于__族_区,价电子排布式为__;
(5)DE3中心原子的杂化方式为__,用价层电子对互斥理论推测其空间构型为__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是分离混合物时常用的仪器,回答下列问题:

(1)写出仪器A、E的名称____、____。
(2)若向C装置中加入碘水和少量CCl4,振荡后静置,会观察到什么现象?____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com