
【题目】某微粒用 AZQn+表示,下列关于该微粒的叙述正确的是( )
A.所含质子数=A-nB.所含中子数=A-Z
C.所含电子数=Z+nD.质量数=Z+A
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.乙烯、苯均能与H2发生加成反应,说明两者均含碳碳双键
B.相同质量的烃完全燃烧,耗氧量最大的是CH4
C.相同质量的乙炔、苯分别在足量氧气中燃烧,苯比乙炔消耗的氧气质量多
D.乙烯、氯乙烯、聚氯乙烯均能使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属(M)-空气电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n。己知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法正确的是
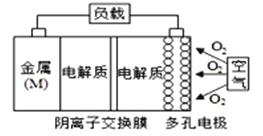
A. 比较Mg、Al、Zn三种金属-空气电池,Mg-空气电池的理论比能量最高
B. M-空气电也放电过程的正极反应式:4Mn++nO2+2nH2O+4ne-=4M(OH)n
C. Al作电极材料时电解质溶液最好选酸性,这样更有利于反应的发生,同时防止负极区沉淀
D. 在Mg-空气电也中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氮气的说法中,错误的是( )
A.通常情况下,氮气性质比较稳定
B.氮气可经一步反应转化成二氧化氮
C.通常情况下,氮气在水中的溶解度很小
D.跟氢气在一定条件下发生反应时,氮气是氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G、H八种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E,B与G,D与H分别为同一主族,C和D的最外层电子数之和为11,C、D、F三种元素的原子序数之和为28。请回答下列问题:
(1)B与D可形成共价化合物X,过量的X与F D2-溶液反应的离子方程式为____________________________
(2)E、F、H所形成的简单离子的半径由大到小的顺序为(用离子符号表示)_________。
(3)G的最高价氧化物与B的单质在高温下能发生置换反应,其化学反应方程式为:
____________________________________________________。
(4)盐Y由B、D、E组成。以熔融盐Y为电解质构成的氢氧燃料电池。写出石墨负极上发生的电极反应式:________________________________。
(5)1g液态A4BD燃烧通常情况下放出13.86KJ热量,写出此物质燃烧热的热化学方程式:_________________________________________________________________
(6)在一个装有可移动活塞的容器中进行如下反应:C2(g)+3A2(g)![]() 2CA3(g),反应达到平衡后,测得容器中含有C2 0.5mol,A20.2mol,CA30.2mol,总容积为1.0L。
2CA3(g),反应达到平衡后,测得容器中含有C2 0.5mol,A20.2mol,CA30.2mol,总容积为1.0L。
①如果达成此平衡前各物质起始的量有以下几种可能,其中不合理的是________:
A.C2 0.6mol, A2 0.5mol, CA30mol
B.C2 0mol, A2 0mol, CA3 1.2mol
C.C2 0.6mol/L,A2 0.5mol/L, CA3 0.1mol/L
②求算此平衡体系的平衡常数K=________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Fe2+、Al3+、Na+。某同学为了确认其成分,取部分试液,设计并完成了如下实验:
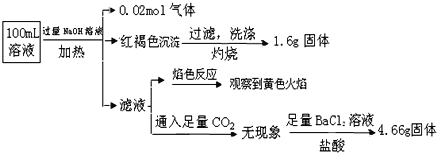
下列说法正确的是
A. 原溶液中c(Fe3+)=0.2mol/L
B. 溶液中至少有4种离子存在,其中Cl-一定存在
C. SO42-、NH4+、Na+一定存在,CO32-一定不存在
D. 要确定原溶液中是否含有Fe2+,其操作为:取少量原溶液于试管中,加入适量氯水,无现象,再加KSCN溶液,溶液成血红色,则含有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组研究铝土矿中Al2O3的含量。已知铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:
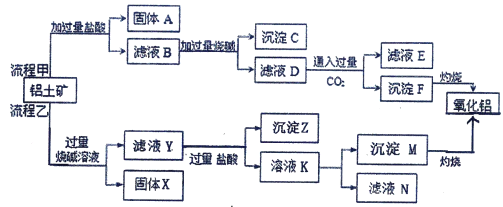
(1)流程甲中加入盐酸后生成Fe3+的离子方程式为________________;固体A是___________(填化学式),写出沉淀F转化为氧化铝的化学方程式是___________________________。
(2)流程乙中,向铝土矿中加入过量烧碱溶液后,发生反应的离子方程式是__________;固体X的主要用途有(写出1条即可) _____。沉淀Z为_______(填化学式)。由溶液K生成沉淀M的离子方程式是_________________________。
(3)流程乙中,将实验过程中所得固体精确称量,课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中Al2O3的质量分数是________(保留一位小数)
(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5mol碳单质,转移1mol电子,反应的化学方程式是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg和Al的混合物投入200 ml稀盐酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法不正确的是( )
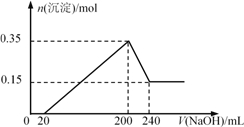
A. Mg和Al的总质量为9g
B. 盐酸的物质的量浓度为5 mol/L
C. NaOH溶液的物质的量浓度为5 mol/L
D. 生成的H2在标准状况下的体积为11.2 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com