
【题目】将一定质量的Mg和Al的混合物投入200 ml稀盐酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法不正确的是( )
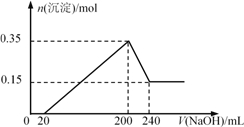
A. Mg和Al的总质量为9g
B. 盐酸的物质的量浓度为5 mol/L
C. NaOH溶液的物质的量浓度为5 mol/L
D. 生成的H2在标准状况下的体积为11.2 L
【答案】D
【解析】根据图像可知,当NaOH的体积0~20mL时,无沉淀产生,说明与过量的HCl反应;NaOH的体积20~200mL时,与溶液中的Mg2+和Al3+反应生成Mg(OH)2和Al(OH)3沉淀;NaOH的体积200~240mL时,Al(OH)3沉淀溶解;A.根据Al(OH)3~NaOH之间关系可知:n(Al)=n [Al(OH)3]=0.2mol,n(Mg)=n[Mg(OH)2]=0.35-0.2=015mol,m总=m(Al) +m(Mg)=0.2mol![]() 27g/mol+0.15mol
27g/mol+0.15mol![]() 24g/mol=9g,A项正确;C.据A可知n(NaOH)= n [Al(OH)3]=0.2mol,c(NaOH)=
24g/mol=9g,A项正确;C.据A可知n(NaOH)= n [Al(OH)3]=0.2mol,c(NaOH)=![]() =5mol/L,C项正确;B.分析可知,n(Al) =n(AlCl3)=0.2mol, n(Mg)=n(MgCl2)=0.15mol,n剩(HCl)=n(NaOH)=0.02L
=5mol/L,C项正确;B.分析可知,n(Al) =n(AlCl3)=0.2mol, n(Mg)=n(MgCl2)=0.15mol,n剩(HCl)=n(NaOH)=0.02L![]() 5mol/L=0.1mol,再根据氯原子守恒可求,n(Cl-)= 3n(AlCl3) +2n(MgCl2)+ n剩(HCl)= 1mol,c(Cl-)=
5mol/L=0.1mol,再根据氯原子守恒可求,n(Cl-)= 3n(AlCl3) +2n(MgCl2)+ n剩(HCl)= 1mol,c(Cl-)=![]() =5mol/L,B项正确;D.根据Mg~H2、2Al~3H2之间的关系可知,n(H2)=(0.15+0.2
=5mol/L,B项正确;D.根据Mg~H2、2Al~3H2之间的关系可知,n(H2)=(0.15+0.2![]()
![]() )=0.45mol,即标况下的体积为V(H2)=0.45mol
)=0.45mol,即标况下的体积为V(H2)=0.45mol![]() 22.4L/mol=10.08 L,D项错误。答案选D。
22.4L/mol=10.08 L,D项错误。答案选D。


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】某微粒用 AZQn+表示,下列关于该微粒的叙述正确的是( )
A.所含质子数=A-nB.所含中子数=A-Z
C.所含电子数=Z+nD.质量数=Z+A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X的最低负价与Y的最高正价代数和为零,下列说法正确的是
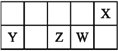
A. 原子半径的大小顺序:r(Y)>r(Z)>r(W)>r(X)
B. Z的最高价氧化物对应水化物的酸性比W的强
C. X的简单气态氢化物的稳定性比W的弱
D. X分别与Y、Z形成的化合物中化学键类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某模拟“人工树叶”电化学实验装置如下图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O),下列说法正确的是( ) 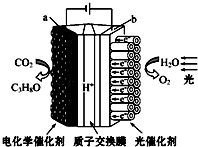
A.该装置将化学能转化为光能和电能
B.a电极的反应为:3CO2+18H+﹣18e﹣═C3H8O+5H2O
C.每生成1 mol O2 , 有44 g CO2被还原
D.该装置工作时H+从b极区向a极区迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有三瓶失去标签的试剂,分别是Na2CO3、NaCl、AgNO3。实验员选择了一种试剂就把它们区别开来了,这种试剂是( )
A. 硝酸 B. 氢氧化钠溶液 C. 氯化钡溶液 D. 盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】还原铁粉是化工生产及实验室中常用的还原剂。工业上以绿矾为原料制备还原铁粉的工艺如下:
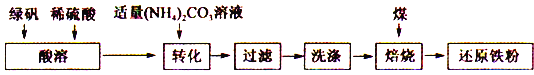
回答下列问题:
(1)酸溶过程中硫酸的作用是________________________ 。
(2)转化的目的是制得FeCO3,加液时应将(NH4)2CO3溶液加入到FeSO4中,原因是_____________。
(3)转化过程中温度不超过35℃,原因是___________________________ 。
(4)生成的FeCO3沉淀需充分洗涤,检验洗涤是否完全的方法是___________________ 。
(5)将FeCO3浊液暴露在空气中,固体表面变为红褐色,同时释放出CO2,写出该反应的化学方程式:________________________ 。
(6)在焙烧过程中需加入CaCO3进行脱硫处理。下图为加CaCO3和不加CaCO3对还原铁粉产率的影响,据图分析CaCO3的另一作用为________________________ 。
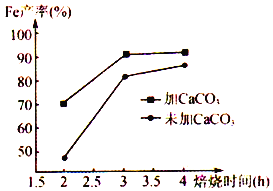
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用二氧化氯(ClO2)可制备用途广泛的亚氯酸钠(NaClO2),实验室可用下列装置(略去部分夹持仪器)制备少量的亚氯酸钠。
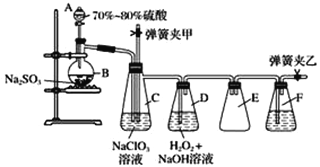
装置C中发生反应:2NaClO3+SO2===2ClO2+Na2SO4(Ⅰ)
装置D中发生反应:2ClO2+H2O2+2NaOH===2NaClO2+2H2O+O2(Ⅱ)
(1)仪器组装完毕,关闭两个弹簧夹,打开A中活塞,向A中注入水可检验装置气密性,装置气密性良好的现象是________________________。实验开始时,打开A的活塞,两个弹簧夹的开关操作是__________________。
(2)装置B中进行的是用硫酸与亚硫酸钠制备二氧化硫的反应,该处使用的是70%~80%的硫酸,而不是98%的浓硫酸或极稀的硫酸,原因是___________________________________。
(3)装置C的作用是________________,装置E的作用是________________。
(4)在碱性溶液中NaClO2比较稳定,所以装置D中应维持NaOH稍过量,判断NaOH是否过量所需要的试剂是________。
a.稀盐酸 b.品红溶液 c.石蕊溶液 d.酚酞溶液
(5)一次实验制备中,通过检验发现制备的NaClO2中含有NaOH、Na2SO3,出现这些杂质的可能原因是__________________。检验产物中含有Na2SO3杂质的实验操作和现象是______________________。 (供选择的试剂有:Ba(OH)2溶液、H2O2溶液、AgNO3溶液、品红溶液、H2SO4溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“空气中氧气体积分数的测定”有多种方法,请按要求回答下列问题:在燃烧匙内盛过量红磷,红磷必须过量的原因是______,点燃红磷后立即插入集气瓶内,塞紧橡皮塞红磷燃烧的现象是____________,其反应的化学方程式为____________________。待红磷火焰熄灭,集气瓶冷却至室温,打开止水夹,观察到的现象是______,该实验除了得出氧气在空气中的体积分数之外,还能得出氮气具有的性质是______(任写一点);若测得空气中氧气的体积分数约为1/7,则可能的原因是______。
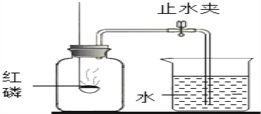
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生进行如下图所示的锌铜原电池的实验。
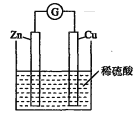
(1)从理论上讲,预期看到的现象是________、_________、_______。
(2)正极上的电极反应:____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com