
����Ŀ����ԭ�����ǻ���������ʵ�����г��õĻ�ԭ������ҵ�����̷�Ϊԭ���Ʊ���ԭ���۵Ĺ������£�
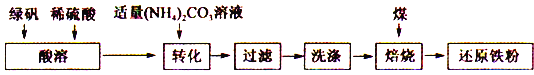
�ش��������⣺
��1�����ܹ����������������________________________ ��
��2��ת����Ŀ�����Ƶ�FeCO3����ҺʱӦ��(NH4)2CO3��Һ���뵽FeSO4�У�ԭ����_____________��
��3��ת���������¶Ȳ�����35�棬ԭ����___________________________ ��
��4�����ɵ�FeCO3��������ϴ�ӣ�����ϴ���Ƿ���ȫ�ķ�����___________________ ��
��5����FeCO3��Һ��¶�ڿ����У���������Ϊ���ɫ��ͬʱ�ͷų�CO2��д���÷�Ӧ�Ļ�ѧ����ʽ��________________________ ��
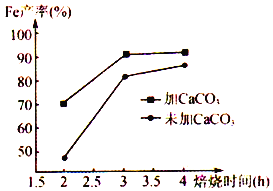
��6���ڱ��չ����������CaCO3��������������ͼΪ��CaCO3�Ͳ���CaCO3�Ի�ԭ���۲��ʵ�Ӱ�죬��ͼ����CaCO3����һ����Ϊ________________________ ��
���𰸡� ����Fe2+ˮ�� ��ֹ�������������� ��ֹ(NH4)2CO3���ȷֽ� ȡ���һ��ϴ����Һ1~2mL���Թ��У������еμ��������ữ��BaCl2��Һ�����ް�ɫ�����������������ϴ�Ӹɾ� 4FeCO3+6H2O+O2==4Fe(OH)3+4CO2 �ֽ������CO2��C��Ӧ���ɻ�ԭ��CO
����������1���̷�����ˮ�õ�������������Һ��Fe2+��ˮ�⣬���ܹ��������������������Fe2+ˮ�⣻��2��ת����Ŀ�����Ƶ�FeCO3����ҺʱӦ��(NH4)2CO3��Һ���뵽FeSO4�У���ֹ������������������3��(NH4)2CO3�����ֽ⣬Ϊ�˼���(NH4)2CO3��Һ�ļ��٣�ת��������Ӧ�����¶���35 �����£���ֹ(NH4)2CO3���ȷֽ⣻��4�����ɵ�FeCO3��������ϴ�ӣ�����ϴ���Ƿ���ȫ�ķ�����ȡ���һ��ϴ����Һ1~2mL���Թ��У������еμ��������ữ��BaCl2��Һ�����ް�ɫ�����������������ϴ�Ӹɾ���(5)���ɫ������Fe(OH)3��FeCO3��H2O��O2��Ӧ����Fe(OH)3��CO2����Ӧ�Ļ�ѧ����ʽΪ��4FeCO3+6H2O+O2==4Fe(OH)3+4CO2����6�������£�̼��Ʒֽ����ɶ�����̼��������̼�ܱ�̼��ԭ����һ����̼�����Լ���̼���������һ����̼�ĺ�������ԭ���۵IJ�������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��F��G��H����Ԫ�طֲ���������ͬ�Ķ����ڣ����ǵ�ԭ������������������B��C��DΪͬһ���ڣ�A��E��B��G��D��H�ֱ�Ϊͬһ���壬C��D������������֮��Ϊ11��C��D��F����Ԫ�ص�ԭ������֮��Ϊ28����ش��������⣺
��1��B��D���γɹ��ۻ�����X��������X��F D2����Һ��Ӧ�����ӷ���ʽΪ____________________________
��2��E��F��H���γɵļ����ӵİ뾶�ɴ�С��˳��Ϊ�������ӷ��ű�ʾ��_________��
��3��G�������������B�ĵ����ڸ������ܷ����û���Ӧ���仯ѧ��Ӧ����ʽΪ��
____________________________________________________��
��4����Y��B��D��E��ɡ���������YΪ����ʹ��ɵ�����ȼ�ϵ�ء�д��ʯī�����Ϸ����ĵ缫��Ӧʽ��________________________________��
��5��1gҺ̬A4BDȼ��ͨ������·ų�13.86KJ������д��������ȼ���ȵ��Ȼ�ѧ����ʽ��_________________________________________________________________
��6����һ��װ�п��ƶ������������н������·�Ӧ��C2��g����3A2��g��![]() 2CA3��g������Ӧ�ﵽƽ���������к���C2��0.5mol��A20.2mol��CA30.2mol�����ݻ�Ϊ1.0L��
2CA3��g������Ӧ�ﵽƽ���������к���C2��0.5mol��A20.2mol��CA30.2mol�����ݻ�Ϊ1.0L��
�������ɴ�ƽ��ǰ��������ʼ���������¼��ֿ��ܣ����в���������________��
A��C2��0.6mol�� A2��0.5mol�� CA30mol
B��C2 0mol�� A2��0mol�� CA3��1.2mol
C��C2��0.6mol/L��A2��0.5mol/L�� CA3��0.1mol/L
�������ƽ����ϵ��ƽ�ⳣ��K��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ����
A. ����������Һ��С�մ���Һ�ķ�Ӧ��H+ + HCO3- = CO2�� + H2O
B. �ÿ�������Һ���չ���SO2��SO2 +2OH-= SO32- + H2O
C. �������̺�Ũ���ᷴӦ��MnO2+4HCl![]() Mn2++2Cl2��+2H2O
Mn2++2Cl2��+2H2O
D. ��ҵ��������ʯ���鷴Ӧ��Ư����Cl2 + 2OH-= ClO-+ Cl- + H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B��C��D��E����Ԫ�أ��������Ϣ�����
Ԫ�� | �����Ϣ |
A | Aԭ�ӵ�1s�����ֻ��1������ |
B | B�ǵ縺������Ԫ�� |
C | C��̬ԭ�ӵ�2p�������3��δ�ɶԵ��� |
D | D������Ԫ������Eͬ���ڣ��������ܲ� |
E | E���γɺ�ɫ����ש��ɫ����E2O�ͺ�ɫ��EO���������� |
��ش��������⣺
��1��д��EԪ��ԭ�ӻ�̬ʱ�ĵ����Ų�ʽ ��
��2��CԪ�صĵ�һ�����ܱ���Ԫ�صĵ�һ�����������С������
��3��CA3������Cԭ�ӵ��ӻ������� ��
��4��A��C��E����Ԫ�ؿ��γ�[E��CA3��4]2+ �� ���д��ڵĻ�ѧ��������������ţ���
����λ�� �ڽ����� �ۼ��Թ��ۼ� �ܷǼ��Թ��ۼ� �����Ӽ� �����
��[E��CA3��4]2+���жԳƵĿռ乹�ͣ��ҵ�[E��CA3��4]2+�е�����CA3������Cl��ȡ��ʱ���ܵõ����ֲ�ͬ�ṹ�IJ����[E��CA3��4]2+�Ŀռ乹��Ϊ������ţ���
a��ƽ�������� b���������� c�������� d��V��
��5��B��D���γ����ӻ�����侧���ṹ��ͼ��ʾ������D���ӵ���λ��Ϊ �� ���þ�����ܶ�Ϊa gcm��3 �� ��þ����������cm3��д������ʽ���ɣ��� 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��������Mg��Al�Ļ����Ͷ��200 mlϡ�����У�����ȫ���ܽⲢ�������塣����Ӧ��ȫ����������Һ�м���NaOH��Һ�����ɳ��������ʵ��������NaOH��Һ�������ϵ��ͼ��ʾ��������˵������ȷ���ǣ�������
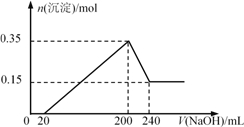
A. Mg��Al��������Ϊ9g
B. ��������ʵ���Ũ��Ϊ5 mol/L
C. NaOH��Һ�����ʵ���Ũ��Ϊ5 mol/L
D. ���ɵ�H2�ڱ�״���µ����Ϊ11.2 L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ӷ���ʽBaCO3��2H��===CO2����H2O��Ba2���е�H�����ܴ�����������( )
��HCl����H2SO4����HNO3����NaHSO4����CH3COOH
A. �٢� B. �٢ܢ� C. �٢� D. �ڢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��Q��R�����ֶ�����Ԫ�أ�ԭ����������������Ԫ�������ڱ��е�λ�ù�ϵ����ͼ��ʾ������X�����ڱ���ԭ�Ӱ뾶��С��Ԫ�أ�Q��Xͬ���壻Z�������������Ǵ�����3����
Y | Z | ||
R |
��ش��������⣺
��1��д��YԪ�ص����ƣ�________��Q��ԭ�ӽṹʾ��ͼ________��R�����ڱ��е�λ��Ϊ________��
��2��Q2Z����ʽΪ��________��Q2Z2���Ļ�ѧ������Ϊ��________��
��3��R��Z�ֱ��γɼ����ӵİ뾶��С��________________�����ӷ��ű�ʾ��
��4��Y���⻯����������������Ӧ��ˮ���ﷴӦ�Ļ�ѧ����ʽΪ��__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʵ��װ�ò��������Ӧʵ����ǣ� ��

A. ��װ�����������������Ļ�ѧ��Ӧ����
B. ��װ�����Ƚ�NaHCO3��Na2CO3�����ȶ���
C. װ�����з�Һ©���ڵ�Һ���˳������������ƿ
D. װ������ʵ����ȡCO2ʵ���е������ؼ�ֹ������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NAΪ����٤�������������������������������ǣ�������
A.0.8 mol������̼
B.��״����2.24L����
C.3.6 gˮ
D.��NA������ӵ�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com