
【题目】已知:2CrO42-+2H+![]() Cr2O72-+H2O。25℃时,调节初始浓度为1.0molL-1的Na2CrO4溶液的pH(忽略溶液体积变化),测定平衡时溶液中c(Cr2O72-)和c(H+),获得如图所示的曲线。下列说法不正确的是( )
Cr2O72-+H2O。25℃时,调节初始浓度为1.0molL-1的Na2CrO4溶液的pH(忽略溶液体积变化),测定平衡时溶液中c(Cr2O72-)和c(H+),获得如图所示的曲线。下列说法不正确的是( )
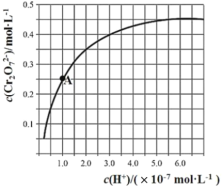
A.平衡时,pH越小,c(Cr2O72-)越大
B.A点CrO42-的平衡转化率为50%
C.A点CrO42-转化为Cr2O72-反应的平衡常数K=1014
D.平衡时,若溶液中c(Cr2O72-)=c(CrO42-),则c(H+)>2.0×10-7mol·L-1
【答案】D
【解析】
A.由图可知氢离子浓度越大,c(Cr2O72-)越大,所以pH越小,c(Cr2O72-)越大,故A正确;
B.由图可知A点时Cr2O72-的平衡浓度为0.25mol/L,所以转化的CrO42-的浓度为:0.5mol/L,则A点CrO42-的平衡转化率为50%,故B正确;
C.2CrO42-+2H+![]() Cr2O72-+H2O的平衡常数为:K=
Cr2O72-+H2O的平衡常数为:K=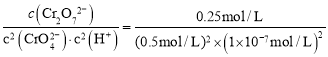 =1014,故C正确;
=1014,故C正确;
D.平衡时,若溶液中c(Cr2O72-)=c(CrO42-),而2c(Cr2O72-)+c(CrO42-)=1.0molL-1,所以c(Cr2O72-)=![]() molL-1,而图中c(Cr2O72-)=0.35mol/L时,对应氢离子的浓度为2.0×10-7 molL-1,则溶液中c(Cr2O72-)=c(Cr2O42-),则c(H+)<2.0×10-7 molL-1,故D错误;
molL-1,而图中c(Cr2O72-)=0.35mol/L时,对应氢离子的浓度为2.0×10-7 molL-1,则溶液中c(Cr2O72-)=c(Cr2O42-),则c(H+)<2.0×10-7 molL-1,故D错误;
故答案为D。


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】硝酸是一种重要的化工原料,工业上采用氨催化氧化法制备,生产过程中发生的反应有:
4NH3(g)+5O2(g)  4NO(g)+6H2O(l) ΔH1=-1169.2 kJ/mol
4NO(g)+6H2O(l) ΔH1=-1169.2 kJ/mol
2NO(g)+O2(g)=2NO2(g) ΔH2=-114.2 kJ/mol
3NO2(g)+H2O(l)=2HNO3(aq)+NO(g) ΔH3=-71.7kJ/mol
回答下列问题:
(1)NH3(g)+2O2(g)=HNO3(aq)+H2O(l)的ΔH=___________kJ/mol。
原料气体(NH3、O2)在进入反应装置之前,必须进行脱硫处理。其原因是________。
(2)研究表明2NO(g)+O2(g) ![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
(a)2NO(g) ![]() N2O2(g)(快) (b)N2O2(g)+O2(g)
N2O2(g)(快) (b)N2O2(g)+O2(g) ![]() 2NO2(g) (慢)
2NO2(g) (慢)
①该反应的速率由b步决定,说明b步反应的活化能比a步的_____(填“大”或“小”)。
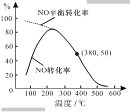
②在恒容条件下,NO和O2的起始浓度之比为2:1,反应经历相同时间,测得不同温度下NO转化为NO2的转化率如右图,则150℃时,v正____v逆(填“>”或“<”)。若起始c(O2)=5.0×104mol·L1,则380℃下反应达平衡时c(O2)=_______ mol·L1。
(3)T1温度时,在容积为2L的恒容密闭容器中发生反应2NO+O2=2NO2,实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)c(O2),v逆=v(NO2)消耗=k逆c2(NO2),k正、k逆为速率常数,受温度影响。容器中各反应物和生成物的物质的量随时间变化如图所示:
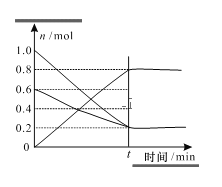
①下列说法能表明该反应已经达到平衡状态的是_______(填序号)
A.混合气体的密度不变
B.混合气体的颜色不变
C.k正、k逆不变
D.2v正(O2)=v逆(NO2)
②化学平衡常数K与速率常数k正、k逆的数学关系式K=___________。
③温度为T1时的化学平衡常数K=_________。若将容器的温度变为T2时k正=k逆,则T2 _______T1(填“>” “<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 是四种短周期元素,它们的核电荷数依次增大,四种元素的性质或原子结构的部分信息如表所示。
是四种短周期元素,它们的核电荷数依次增大,四种元素的性质或原子结构的部分信息如表所示。
元素 | 元素性质或原子结构的部分信息 |
| 元素的离子核外无电子 |
| 地壳中含量最多的元素 |
| 元素的离子半径在该周期中最小 |
|
|
下列叙述不正确的是( )
A.![]() 与
与![]() 形成的化合物在常温下为气体
形成的化合物在常温下为气体
B.![]() 的最高价氧化物对应的水化物不与
的最高价氧化物对应的水化物不与![]() 溶液反应
溶液反应
C.![]() 和
和![]() 形成的常见化合物能形成酸雨
形成的常见化合物能形成酸雨
D.简单氢化物的稳定性:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F均为短周期主族元素,且它们的原子序数依次增大,B和E同主族,A、B在元素周期表中处于相邻的位置,C元素原子在同周期主族元素原子中半径最大,D是地壳中含量最多的金属元素,E元素原子的最外层电子数是电子层数的2倍。请回答下列问题。
(1)画出F的原子结构示意图:__。
(2)B、C、E的简单离子的半径由大到小的顺序为__(用离子符号表)。
(3)在加热条件下,B的常见单质与C的单质发生反应,将所得产物溶于水时所发生反应的化学方程式为__。
(4)D的单质能与C的最高价氧化物对应水化物的溶液反应生成无色气体,该反应中的氧化剂为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗和铝在周期表中处于对角线位置,二者的单质及化合物的性质对应相似。下列关于锗及其化合物的推断正确的是
A.锗不能与强碱溶液反应
B.氢氧化锗具有两性
C.氧化锗易溶于水
D.氧化锗的化学式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与金属腐蚀有关的说法正确的是( )

A. 图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B. 图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C. 图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D. 图d中,钢铁轮船外壳连接一块金属A(铜块)可以减缓船体外壳腐蚀速度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁[(C5H5)2Fe]分子是一种金属有机配合物,是燃料油的添加剂,用以提高燃烧的效率和 去烟,可作为导弹和卫星的涂料等。它的结构如图所示,下列说法不正确的是
A.1mol 环戊二烯( ![]() )中含有σ键的数目为1NA
)中含有σ键的数目为1NA
B.环戊二烯中碳原子的杂化方式有 sp3 和 sp2
C.二茂铁属于分子晶体
D.二茂铁分子中的化学键有极性共价键、非极性共价键和配位键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池可净化废水,同时还能获得能源或有价值的化学产品,图1为其工作原理,图2为废水中Cr2O72-浓度与去除率的关系。下列说法不正确的是( )
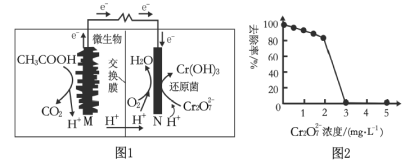
A.图1燃料电池工作一段时间后,N极附近的溶液pH增大
B.外电路转移2 mol电子时,N极消耗标准状况下11.2 L O2
C.图2中Cr2O72-浓度较大时,其去除率下降可能是Cr2O72-浓度较大造成还原菌失活所致
D.M极为电池负极,发生的电极反应为CH3COOH+2H2O-8e-=2CO2↑+8H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com