
【题目】氢氧化镍在乙醇的悬浊液中可发生如下反应生成单质镍的配合物:Ni(OH)2+5CH3NC=(CH3NC)4Ni+CH3NCO+H2O
(1)Ni2+基态核外电子排布式为________。
(2)CH3NC(其结构简式为CH3- N ![]() C)分子中碳原子轨道的杂化类型是_____;1molCH3NC中σ键的数目为_______。
C)分子中碳原子轨道的杂化类型是_____;1molCH3NC中σ键的数目为_______。
(3)用光气(COCl2)与甲胺(CH3NH2)可以制取CH3NCO。
①与COCl2互为等电子体的一种阴离子为___。
②甲胺极易溶于水,除因为它们都是极性分子外,还因为___。
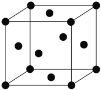
(4)Ni单质的晶胞结构如下图所示,晶体中每个Ni原子周围与之距离最近的原子个数为______。
【答案】[Ar]3d8 SP3 杂化、SP 杂化 5mol NO3- 或CO32- 甲胺与水形成分子间氢键 12
【解析】
(1)Ni元素原子核外有28个电子,原子核外电子排布为1s22s22p63s23p63d84s2,Ni失去4s能级2个电子形成Ni2+;
(2)根据CH3N![]() C中碳原子形成的价层电子对数判断杂化轨道形式;单键均为σ键,叁键中含有1个σ键,2个π键;
C中碳原子形成的价层电子对数判断杂化轨道形式;单键均为σ键,叁键中含有1个σ键,2个π键;
(3)①原子数和价电子数都相等的微粒互为等电子体;
②分子间存在氢键溶解性增强;
(4)晶胞中顶点Ni原子与面心Ni原子间距离最短。
(1) Ni元素原子核外有28个电子,原子核外电子排布为1s22s22p63s23p63d84s2,Ni失去4s能级2个电子形成Ni2+,Ni2+离子核外电子排布式为:1s22s22p63s23p63d8,所以Ni2+基态核外电子排布式为[Ar]3d8;
(2) CH3NC中甲基上的碳形成的价层电子对数为4,无孤对电子,则为sp3 杂化,而碳氮叁键中的碳形成的价层电子对数为2,则为sp杂化,单键均为σ键,叁键中含有1个σ键,则1molCH3NC中σ键的5mol;
(3)①原子数和价电子数都相等的微粒互为等电子体,与COCl2互为等电子体的阴离子的化学式为CO32-或NO3-;
②水是极性溶剂,而甲胺是极性分子,且能与水形成分子间氢键,所以甲胺极易溶于水;
(4) 晶胞中顶点Ni原子与面心Ni原子间距离最短,则晶体中每个Ni原子周围与之距离最近的原子个数为8×3×![]() =12。
=12。


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】N2的结构可以表示为 ,CO的结构可以表示为
,CO的结构可以表示为 ,其中椭圆框表示 π键,下列说法不正确的是( )
,其中椭圆框表示 π键,下列说法不正确的是( )
A.N2 分子与 CO 分子中都含有三键
B.CO 分子中有一个 π 键是配位键
C.N2 与 CO 互为等电子体
D.N2 与 CO 的化学性质相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为 。下列关于该有机物分子结构的说法中正确的是
。下列关于该有机物分子结构的说法中正确的是
A. 最多有18个原子在同一平面内 B. 最多有4个碳原子在一条直线上
C. 最多有12个碳原子在同一平面内 D. 所有原子都可能在同一平面内
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油裂化可得到有机物(CH3)2C=C(CH3)2(以下用A表示)。
(1)A的官能团名称为________;A在通常状况下呈________(填“气”“液”或“固”)态。
(2)A与Br2的加成产物B与NaOH的乙醇溶液共热可生成二烯烃C,则C的结构简式为:___________________;B生成C的反应类型为______________。
(3)C与一定量Br2反应可能生成D、E和G,而D与HBr的加成产物只有F,则D形成高分子化合物的化学方程式为__________________________________________。
(4)C的同分异构体中不可能为________(填字母)
a.芳香烃 b.炔烃 c.环烯烃 d.二烯烃
若C的一种同分异构体H与KMnO4酸性溶液生成己二酸,则H的结构简式为________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业是一种高耗能产业,一种将燃料电池与电解池组合的新工艺可节能30%以上,下图是该工艺图示(电极未标出)。
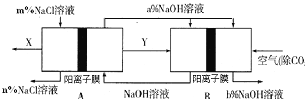
下列说法正确的是
A.X为H2,Y为Cl2
B.A池为电解池,且m<n
C.B池为燃料电池,且a<b
D.该工艺优点是燃料电池提供电能且能提高烧碱产品的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、生产、环境等密切相关。下列说法错误的是
A.煤的液化、石油的裂化和油脂的皂化都属于化学变化
B.棉、丝、毛、油脂都是天然有机高分子化合物
C.乙烯与氧气在银催化作用下生成环氧乙烷原子利用率为100%
D.海水淡化的方法有蒸馏法、电渗析法等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】位于不同主族的四种短周期元素甲、乙、丙、丁,其原子序数依次增大,原子半径r(丁)>r(乙)>r(丙)>r(甲)。四种元素中,只有一种为金属元素,乙和丙原子的最外层电子数之和为丁原子的最外层电子数的3倍。据此推断,下述正确的是
A.简单氢化物的沸点:乙>丙
B.由甲、乙两元素组成的化合物溶于水呈碱性
C.丙和丁两元素的最高价氧化物的水化物之间能发生反应
D.由甲和丙两元素组成的分子,不可能含非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫能起漂白、保鲜作用,使物品颜色显的白亮、鲜艳。如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。下列有关说法正确的是
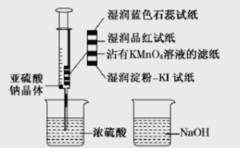
A.蓝色石蕊试纸变红后褪色
B.NaOH溶液可用于除去实验中多余的SO2
C.湿润淀粉-KI试纸未变蓝,说明SO2有还原性
D.品红试纸、沾有KMnO4溶液滤纸均褪色,证明了SO2的漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会对环境造成严重影响。对燃煤废气进行脱硝脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。
利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ/mol
则甲烷直接将NO2还原为N2的热化学方程式为________________。
(2)脱碳。
将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
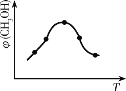
①取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图所示,则上述CO2转化为甲醇的反应热△H3_____0(填“>”“<”或“=”),该反应的平衡常数表达式为_______________。
②在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图所示,试回答:
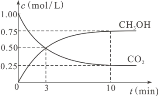
0~10 min内,氢气的平均反应速率为 ___________________mol/(L·min)。第10 min后,若向该容器中再充入1 mol CO2和3 mol H2,则再次达到平衡时CH3OH(g)的体积分数____________ (填“增大”“减小”或“不变”,下同),反应的平衡常数_____________________。
(3)脱硫。
①有学者想利用如图所示装置用原电池原理将SO2转化为重要的化工原料。AB是惰性电极,A极的电极反应式为:_________。

②某种脱硫工艺中将废气处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物,可作为化肥。常温下,将NH4NO3 溶解于水中,为了使该溶液中的NH4+ 和 NO3-离子的物质的量浓度之比等于1 : 1,可以采取的正确措施为_________。
A.加入适量的硝酸,抑制 NH4+的水解
B.加入适量的氨水,使溶液的 PH = 7
C.加入适量的 NaOH 溶液,使溶液的PH = 7
D.加入适量的NH4NO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com