
【题目】氯碱工业是一种高耗能产业,一种将燃料电池与电解池组合的新工艺可节能30%以上,下图是该工艺图示(电极未标出)。
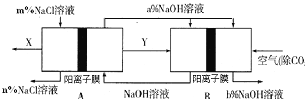
下列说法正确的是
A.X为H2,Y为Cl2
B.A池为电解池,且m<n
C.B池为燃料电池,且a<b
D.该工艺优点是燃料电池提供电能且能提高烧碱产品的浓度
【答案】CD
【解析】
如图:
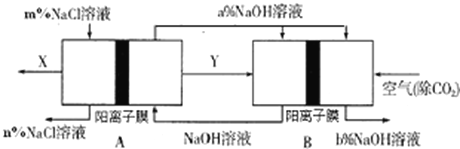
根据图片知,B装置中通入空气和Y,空气作氧化剂,且整个装置是原电池和电解池组合的装置,B能自发的进行氧化还原反应,所以B是原电池,则A是电解池;据以上分析解答。
A.通过以上分析知,A是电解池,B是原电池,原电池中燃料是氢气,所以Y是氢气,则X是氯气,故A错误;
B.A是电解池,电解氯化钠过程中,氯化钠溶液被电解时生成氯气、氢气和氢氧化钠,所以导致溶液中氯化钠浓度降低,所以m>n,故B错误;
C.B是燃料电池,正极上氧气得电子和水反应生成氢氧根离子,导致正极区域氢氧化钠浓度增大,所以a<b,故C正确;
D.B装置是把化学能转变为电能的装置,属于原电池,且正极上氧气得电子和水反应生成氢氧根离子,导致正极区域氢氧化钠浓度增大,故D正确;
故选CD。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知反应N2(g)+3H2(g)![]() 2NH3(g),某温度下,向体积固定的1L密闭容器中充入1mol N2(g)和3mol H2(g),测得不同时刻反应前后的压强关系如下表所示:
2NH3(g),某温度下,向体积固定的1L密闭容器中充入1mol N2(g)和3mol H2(g),测得不同时刻反应前后的压强关系如下表所示:
时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
压强比值P后/P前 | 0.98 | 0.88 | 0.80 | 0.75 | 0.75 | 0.75 |
(1)0~15min内,用H2表示的平均反应速率为v(H2) =___________________mol·L-1·min-1。
(2)达到平衡时N2的转化率为________,该温度下的平衡常数为___________(保留两位小数)。
(3)已知该反应为放热反应,下图为不同条件下反应速率随时间的变化情况(每次仅改变一个条件):a时改变的条件可能是____________;b时改变的条件可能是_______________。

(4)一定条件下的密闭容器中,该反应达到平衡后要提高H2的转化率,可以采取的措施有(_________)
A.低温低压 B.加入催化剂 C.增加N2的浓度 D.增加H2的浓度 E.分离出NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,置入一定量的 NO(g)和足量C(s),发生反应 C(s)+2NO(g)![]() CO2(g)+N2(g),平衡状态时 NO(g)的物质的量浓度 c(NO)与温度 T 的关系如图所示。则下列说法中正确的是( )
CO2(g)+N2(g),平衡状态时 NO(g)的物质的量浓度 c(NO)与温度 T 的关系如图所示。则下列说法中正确的是( )
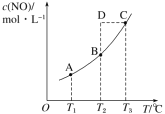
A.该反应的 ΔH>0B.若该反应在 T1、T2 时的平衡常数分别为 K1、K2,则 K1<K2
C.在 T3 时,若混合气体的密度不再变化,则可以判断反应达到平衡状态 CD.在 T2 时,若反应体系处于状态D,则此时一定有 v 正<v 逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、R、W原子序数依次增大,其原子的最外层电子数之和为22。X与Y位于同一周期,X与Z、Y与W分别位于同一主族;R最外层电子数是电子层数的2倍。下列叙述正确的是
A.五种元素中X元素的原子半径最小B.最高正价:Y>R
C.最高价氧化物对应水化物的酸性:W>RD.最高价氧化物的水化物碱性:X>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于化学方程式SiO2+3C![]() SiC+2CO↑,有关叙述正确的是
SiC+2CO↑,有关叙述正确的是
A. 反应中SiO2是氧化剂,C是还原剂
B. 硅元素被还原了,碳元素被氧化了
C. 在反应中C既是氧化剂又是还原剂
D. 在反应中氧化剂与还原剂的物质的量之比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化镍在乙醇的悬浊液中可发生如下反应生成单质镍的配合物:Ni(OH)2+5CH3NC=(CH3NC)4Ni+CH3NCO+H2O
(1)Ni2+基态核外电子排布式为________。
(2)CH3NC(其结构简式为CH3- N ![]() C)分子中碳原子轨道的杂化类型是_____;1molCH3NC中σ键的数目为_______。
C)分子中碳原子轨道的杂化类型是_____;1molCH3NC中σ键的数目为_______。
(3)用光气(COCl2)与甲胺(CH3NH2)可以制取CH3NCO。
①与COCl2互为等电子体的一种阴离子为___。
②甲胺极易溶于水,除因为它们都是极性分子外,还因为___。
(4)Ni单质的晶胞结构如下图所示,晶体中每个Ni原子周围与之距离最近的原子个数为______。
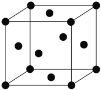
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2A是二元弱酸,25℃时,配制一组c(H2A)+c(HA-)+c(A2-)=0.1mol·L-1的H2A和NaOH混合溶液,溶液中H2A、HA-和A2-所占三种粒子总数的物质的量分数(α)随溶液pH变化的关系如图所示。下列说法正确的是
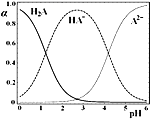
A.c(Na+)=0.1mol·L-1的溶液中:c(H+)=c(A2-)+c(OH-)-c(H2A)
B.c (HA-)=c(A2-)的溶液中:c(Na+)>3c(A2-)
C.c (HA-)=0.5mol·L-1的溶液中:2c(H2A)+c(H+)=c(OH-)+1.5mol·L-1
D.pH=2的溶液中:c(HA-)+2c(A2-)<0.1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯氧化铜[xCuO·yCuCl2·zH2O]在农业上用作杀菌剂。工业上用铜矿粉(主要含Cu2(OH)2CO3、Fe3O4等)为原料制取氯氧化铜的流程如下:

⑴“调节pH”并生成Fe(OH)3时反应的离子方程式为______。
⑵调节pH,要使常温溶液中c(Cu2+)≥0.022mol·L-1,而c(Fe3+)≤1×10-6mol·L-1,则应调节pH的范围为______。{已知Ksp[Cu(OH)2=2.2×10-20],Ksp[Fe(OH)3=1×10-36]}
⑶为测定氯氧化铜的组成,现进行如下实验:
步骤Ⅰ:称取0.4470 g氯氧化铜,放入锥形瓶,加入一定量30%的硝酸使固体完全溶解。滴加K2CrO4溶液作指示剂,用0.1000mol·L-1 AgNO3标准溶液滴定溶液中的Cl-,滴定至终点时消耗AgNO3标准溶液20.00 mL;
步骤Ⅱ:称取0.4470g氯氧化铜,放入锥形瓶,加入一定量硫酸使固体完全溶解。向溶液中加入过量的KI固体,充分反应后向溶液中滴入数滴淀粉溶液,用0.2000mol·L-1Na2S2O3标准溶液滴定,滴定至终点时消耗Na2S2O3标准溶液20.00mL。
已知步骤Ⅱ中所发生的反应如下:
2Cu2++4I-=2CuI↓+I2 2Na2S2O3+I2=2NaI+Na2S4O6
①已知Ag2CrO4为砖红色沉淀,步骤Ⅰ滴定终点时的实验现象是_______。
②通过计算确定氯氧化铜的化学式________________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列文字表述与反应方程式对应且正确的是( )
A.氧化铁溶于氢碘酸:Fe2O3+6H+===2Fe3++3H2O
B.含等物质的量的KHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-===BaCO3↓+H2O
C.向氯化铝溶液中加入过量氨水:Al3++4NH3·H2O=== AlO2-+4NH4++2H2O
D.向Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O![]() CaSO3↓+2HClO
CaSO3↓+2HClO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com