
【题目】已知反应N2(g)+3H2(g)![]() 2NH3(g),某温度下,向体积固定的1L密闭容器中充入1mol N2(g)和3mol H2(g),测得不同时刻反应前后的压强关系如下表所示:
2NH3(g),某温度下,向体积固定的1L密闭容器中充入1mol N2(g)和3mol H2(g),测得不同时刻反应前后的压强关系如下表所示:
时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
压强比值P后/P前 | 0.98 | 0.88 | 0.80 | 0.75 | 0.75 | 0.75 |
(1)0~15min内,用H2表示的平均反应速率为v(H2) =___________________mol·L-1·min-1。
(2)达到平衡时N2的转化率为________,该温度下的平衡常数为___________(保留两位小数)。
(3)已知该反应为放热反应,下图为不同条件下反应速率随时间的变化情况(每次仅改变一个条件):a时改变的条件可能是____________;b时改变的条件可能是_______________。

(4)一定条件下的密闭容器中,该反应达到平衡后要提高H2的转化率,可以采取的措施有(_________)
A.低温低压 B.加入催化剂 C.增加N2的浓度 D.增加H2的浓度 E.分离出NH3
【答案】0.08 50% 0.59 加入催化剂 加入N2或H2 CE
【解析】
在计算反应速率时,要注意题干中提供的是物质的物质的量还是物质的量浓度,以选择合适的公式正确计算;由题中提供的表格可知,大约20min时,该反应达到平衡状态,平衡状态时,压强变为初始的0.75倍,借助公式![]() 可知此时容器内气体的总物质的量,再经过三段式计算即可得到此条件下的K;一般,升高温度或增大压强会使反应速率都增大,温度变化导致速率改变的同时,平衡状态也必然发生移动,但压强就不一定;对于催化剂,其加入会使反应速率都增加,同时也不会影响平衡状态;转化率与多种因素有关,如温度,压强,浓度以及投料比等。
可知此时容器内气体的总物质的量,再经过三段式计算即可得到此条件下的K;一般,升高温度或增大压强会使反应速率都增大,温度变化导致速率改变的同时,平衡状态也必然发生移动,但压强就不一定;对于催化剂,其加入会使反应速率都增加,同时也不会影响平衡状态;转化率与多种因素有关,如温度,压强,浓度以及投料比等。
(1)0~15min,压强变为最初的0.80倍,由公式![]() 可知,气体总物质的量变化为初始的0.80倍,列三段式:
可知,气体总物质的量变化为初始的0.80倍,列三段式: ,则有
,则有![]() ,解得x=0.4,所以15min内氢气的量减少了1.2mol,那么
,解得x=0.4,所以15min内氢气的量减少了1.2mol,那么![]() ;
;
(2)由题可知,达到平衡时,气体的压强变为初始的0.75倍,由公式![]() 可知,气体总物质的量变为初始的0.75倍,列三段式:
可知,气体总物质的量变为初始的0.75倍,列三段式: ,则有
,则有![]() ,解得x=0.5,所以平衡时,N2,H2,NH3的物质的量分别为0.5mol,1.5mol,1mol,浓度即分别0.5mol/L,1.5mol/L,1mol/L,所以平衡状态时N2转化率为:
,解得x=0.5,所以平衡时,N2,H2,NH3的物质的量分别为0.5mol,1.5mol,1mol,浓度即分别0.5mol/L,1.5mol/L,1mol/L,所以平衡状态时N2转化率为:![]() ,平衡常数为:
,平衡常数为: ;
;
(3)由图可知,a时改变条件后,正逆反应速率都增大,但是平衡状态未发生变化,考虑到该反应若只改变压强平衡一定会发生移动,所以改变的条件只能是催化剂的加入;b时,条件改变后逆反应速率未变化,而正反应速率瞬间增大,所以条件可能是增大反应物N2或H2的浓度;
(4)A.该反应是放热反应,因此低温条件下有利于反应正向进行,对提高氢气转化率有帮助;由于该反应气体总量减小,所以减压会使反应逆向进行,对提高氢气转化率不利,A项错误;
B.催化剂对于平衡无影响,无法改变氢气的转化率,B项错误;
C.仅增大氮气的浓度,会使平衡正向移动,氢气转化率提高,C项正确;
D.增加氢气的浓度,虽然会使平衡正向移动,但是相反的,氢气的转化率会下降,D项错误;
E.将产物氨气从体系内分离出去,可以使平衡正向移动,进而提高氢气的转化率,E项正确;
答案选CE。


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案科目:高中化学 来源: 题型:
【题目】(1)下列有关说法正确的是_________________。
A.用金属的电子气理论能合理地解释金属易腐蚀的原因
B.手性催化剂只催化或者主要催化一种手性分子的合成
C.草酸二甲酯分子中σ键和π键个数比为6:1
D.MgCO3的热稳定性强于BaCO3
E.根据火山喷出的岩浆中冷却时ZnS比HgS先析出,能判断ZnS的晶格能大于HgS
(2)已知SbCl3、SbCl5、SnCl4的熔点依次为73.5℃、2.8℃、-33℃。依据上述实验事实回答:
①SnCl4中Sn的杂化类型为________,SbCl5的晶体类型为_______,SbCl3的空间构型为____________。
②实验测得在极性溶剂中SbCl5的溶解度比SbCl3的溶解度小得多,其主要原因是___________。
(3)人们一直致力于人工固氮的研究,以获得廉价的氮肥。科学家先后提出并合成了固氮酶的多种模拟物。其中一类是含Mo(钼)、Fe、S原子的类立方体结构,如下图所示:

图中所有实线均代表化学键,左右两边对称,各含一个类立方体的结构。每个类立方体含有4个Fe原子、4个S原子,它们位于立方体的8分顶点,且同种原子不相邻。(已知元素电负性分别为:S—2.5 Fe—1.8 Mo—1.8)
①Mo与Cr是同族元素,并且位于相邻周期,写出基态Mo原子的价电子的轨道表达式为_____________。
②钼是一种人体必需的微量元素。工业上可用辉钼矿(MoS2)焙烧除硫得三氧化钼,写出该过程的化学方程式___________________。
③上述一个类立方体中4个Fe原子所在的顶点连接所构成的空间几何体为_____________。
④在类立方体结构中,一种最近的S原子和S原子间距离为apm,该结构的密度为_______g/cm3(已知NA,只需列式,无需化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊噻嗪是治疗水肿及高血压的药物,其中间体G的一种合成路线如下:

回答下列问题:
(1)A的化学名称是_____________。B中含有官能团的名称为_____________。
(2)反应②的反应类型是________________。
(3)C的结构简式为_______________。
(4)G与新制Cu(OH)2反应的化学方程式为___________________。
(5)X与E互为同分异构体,X中含有六元碳环,且X能与NaOH溶液反应,则符合条件的X的结构简式为_________________。
(6)设计由1,3-丙二醇和丙二酸二乙酯制备 的合成路线(其他试剂任选)______________。
的合成路线(其他试剂任选)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中的颜色变化,与氧化还原反应无关的是
A | B | C | D | |
实验 | 新制氯水滴入Na2S 溶液中 | 乙醇滴入K2Cr2O7酸性溶液中 | 饱和FeCl3溶液滴入沸水中 | 草酸滴入KMnO4 酸性溶液中 |
现象 | 产生黄色浑浊 | 溶液由橙色变为绿色 | 液体变为红褐色且澄清透明 | 产生无色气体,溶液紫红色褪去 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质有如下转化关系,E为淡黄色粉末,通常用在呼吸面具中作为氧气的来源。

(1)A、C、E、F的化学式:
A______,C______,E______,F______。
(2)向饱和的C的溶液中通入足量CO2,会出现的现象是_____,有关反应的化学方程式为____。
(3)鉴别C与F溶液应选用的试剂是_____,有关反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2的结构可以表示为 ,CO的结构可以表示为
,CO的结构可以表示为 ,其中椭圆框表示 π键,下列说法不正确的是( )
,其中椭圆框表示 π键,下列说法不正确的是( )
A.N2 分子与 CO 分子中都含有三键
B.CO 分子中有一个 π 键是配位键
C.N2 与 CO 互为等电子体
D.N2 与 CO 的化学性质相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL混合液中,HNO3和H2SO4的物质的量浓度分别为0.1mol/L和0.4mol/L。向该混合液中加入1.92g铜粉,加热使反应发生完全。下列说法正确的是(忽略反应前后溶液体积变化)( )
A.所得溶液中c(Cu2+)=0.225mol/L
B.所得溶液中c(H+)=0.5mol/L
C.所得气体在标准状况下的体积为0.448L
D.反应中转移0.06mol的电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,将1.0L c mol·L-1 CH3COOH溶液与0.1mol NaOH固体混合,使之充分反应。然后向该混合溶液中通入HCl气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量的变化如图所示。下列叙述错误的是( )
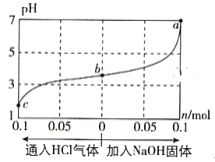
A. 水的电离程度:a>b>c
B. c点对应的混合溶液中:c(CH3COOH)>c(Na+)>c(OH-)
C. a点对应的混合溶液中:c(Na+)=c(CH3COO-)
D. 该温度下,CH3COOH的电离平衡常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业是一种高耗能产业,一种将燃料电池与电解池组合的新工艺可节能30%以上,下图是该工艺图示(电极未标出)。
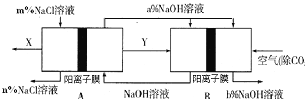
下列说法正确的是
A.X为H2,Y为Cl2
B.A池为电解池,且m<n
C.B池为燃料电池,且a<b
D.该工艺优点是燃料电池提供电能且能提高烧碱产品的浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com