
【题目】(1)下列有关说法正确的是_________________。
A.用金属的电子气理论能合理地解释金属易腐蚀的原因
B.手性催化剂只催化或者主要催化一种手性分子的合成
C.草酸二甲酯分子中σ键和π键个数比为6:1
D.MgCO3的热稳定性强于BaCO3
E.根据火山喷出的岩浆中冷却时ZnS比HgS先析出,能判断ZnS的晶格能大于HgS
(2)已知SbCl3、SbCl5、SnCl4的熔点依次为73.5℃、2.8℃、-33℃。依据上述实验事实回答:
①SnCl4中Sn的杂化类型为________,SbCl5的晶体类型为_______,SbCl3的空间构型为____________。
②实验测得在极性溶剂中SbCl5的溶解度比SbCl3的溶解度小得多,其主要原因是___________。
(3)人们一直致力于人工固氮的研究,以获得廉价的氮肥。科学家先后提出并合成了固氮酶的多种模拟物。其中一类是含Mo(钼)、Fe、S原子的类立方体结构,如下图所示:

图中所有实线均代表化学键,左右两边对称,各含一个类立方体的结构。每个类立方体含有4个Fe原子、4个S原子,它们位于立方体的8分顶点,且同种原子不相邻。(已知元素电负性分别为:S—2.5 Fe—1.8 Mo—1.8)
①Mo与Cr是同族元素,并且位于相邻周期,写出基态Mo原子的价电子的轨道表达式为_____________。
②钼是一种人体必需的微量元素。工业上可用辉钼矿(MoS2)焙烧除硫得三氧化钼,写出该过程的化学方程式___________________。
③上述一个类立方体中4个Fe原子所在的顶点连接所构成的空间几何体为_____________。
④在类立方体结构中,一种最近的S原子和S原子间距离为apm,该结构的密度为_______g/cm3(已知NA,只需列式,无需化简)。
【答案】 BE sp3 分子晶体 三角锥 SbCl2为非极性分子,SbCl3为极性分子,依据相似相容原理SbCl3在水中溶解度大 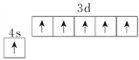 2MoS2+7O2
2MoS2+7O2![]() 2MoO3+4SO2 正四面体
2MoO3+4SO2 正四面体 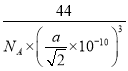
【解析】(1)A.用金属的电子气理论只能解释金属的物理性质,不能解释金属易腐蚀,A错误;B.手性催化剂只催化或者主要催化一种手性分子的合成,B正确;C.草酸二甲酯的结构简式为CH3OOC-COOCH3,所以分子中σ键和π键个数比为13:2,C错误;D.MgCO3的热稳定性弱于BaCO3,D错误;E.根据火山喷出的岩浆中冷却时ZnS比HgS先析出,能判断ZnS的晶格能大于HgS,E正确,答案选BE;(2)①SnCl4中Sn的价层电子对数是4,杂化类型为sp3 ;SbCl5的熔点低,其晶体类型为分子晶体;SbCl3中Sb的价层电子对数是4,且含有一对孤对电子,所以空间构型为三角锥形。②SbCl2为非极性分子,SbCl3为极性分子,依据相似相容原理SbCl3在水中溶解度大。(3)①Mo与Cr是同族元素,并且位于相邻周期,则根据Cr的核外电子排布可判断基态Mo原子的价电子的轨道表达式为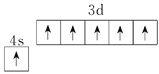 。②工业上可用辉钼矿(MoS2)焙烧除硫得三氧化钼,同时还有SO2生成,反应的化学方程式为2MoS2+7O2
。②工业上可用辉钼矿(MoS2)焙烧除硫得三氧化钼,同时还有SO2生成,反应的化学方程式为2MoS2+7O2![]() 2MoO3+4SO2。③由信息可知,小正方体中4个铁原子应在互不相邻的顶点上,且这四个顶点连接构成正四面体。④在类立方体结构中,一种最近的S原子和S原子间距离为apm,即面对角线是1pm,则晶胞的边长是
2MoO3+4SO2。③由信息可知,小正方体中4个铁原子应在互不相邻的顶点上,且这四个顶点连接构成正四面体。④在类立方体结构中,一种最近的S原子和S原子间距离为apm,即面对角线是1pm,则晶胞的边长是![]() 。晶胞中铁和S均是1/2,所以该结构的密度为
。晶胞中铁和S均是1/2,所以该结构的密度为 。
。


科目:高中化学 来源: 题型:
【题目】已知元素X和Y的核电荷数都小于18,最外层电子数分别为n和(m-5),次外层分别有(n+2)个和m个电子。甲和乙分别为元素X、Y的最高价氧化物的水化物。
(1)元素名称X为____________________,Y为____________________。
(2)甲的化学式是____________________,乙的化学式是____________________。
(3)甲与乙反应的离子方程式是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气中含有SO2,易形成酸雨、污染大气。有效去除和利用SO2是环境保护的重要议题。
(1)双碱法洗除SO2。NaOH溶液![]() Na2SO3溶液
Na2SO3溶液
①上述过程生成Na2SO3的离子方程式为_________。
②双碱法洗除SO2的优点为_________。
(2)NaClO2氧化法吸收SO2。向NaClO2溶液中通入含有SO2的烟气,反应温度为323 K,反应一段时间。
①随着吸收反应的进行,吸收剂溶液的pH逐渐_________(填“增大”“不变”或“减小”)。
②如果采用NaClO替代NaClO2,也能得到较好的烟气脱硫效果。吸收等量的SO2,所需NaClO的物质的量是NaClO2的_________倍。
(3)SO2的利用。生产焦亚硫酸钠(Na2S2O5),通常是由NaHSO3过饱和溶液经结晶脱水制得。利用烟道气中的SO2生产Na2S2O5的工艺如下:
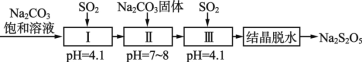
①Ⅰ中反应的化学方程式为___________。
②若Ⅲ中通入SO2不足,结晶脱水得到的Na2S2O5中混有的主要杂质是_______(填化学式)。
③工艺中加入Na2CO3固体,并再次充入SO2的目的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 Na2FeO4是一种离效多功能水处理剂。一种制备Na2FeO4的方法可用化学方程式表示如下:2Fe + 6Na2O2 = 2Na2FeO4 + 2 ![]() + O2↑。下列对此反应的说法中,不正确的是
+ O2↑。下列对此反应的说法中,不正确的是
A.方框中的物质为Na2SO4
B.Na2O2既是氧化剂,又是还原剂
C.Na2FeO4既是氧化产物,又是还原产物
D.2molFeSO4发生反应时,反应中共转移8mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酒石酸托特罗定主要用于治疗泌尿系统疾病。工业合成该药物的中间体(F)的路线如下:
回答下列问题:
(1)D分子中的含氧官能团名称为 __________;B→C包含两步反应,反应类型分别为_______、_______;
(2)A的结构简式为________;
(3)写出苯甲醛与银氨溶液反应的化学方程式 _______;
(4)写出同时满足下列条件的B的一种同分异构体的结构简式:_____________;
①能使溴的CCl4溶液褪色;②能与FeCl3溶液发生显色反应;③苯环上的一氯代物有一种;④分子中有4种不同化学环境的氢。
(5)已知呋喃丙胺(![]() CH=CHCON(CH3)2 )是一种高效麻醉剂,写出以
CH=CHCON(CH3)2 )是一种高效麻醉剂,写出以![]() 、CH3CHO、NH(CH3)2为原料制备呋喃丙胺的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_________________。
、CH3CHO、NH(CH3)2为原料制备呋喃丙胺的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】80℃时,NO2(g)+SO2(g)![]() SO3(g)+NO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入NO2和SO2,起始浓度如下表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列判断不正确的是( )
SO3(g)+NO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入NO2和SO2,起始浓度如下表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列判断不正确的是( )
起始浓度 | 甲 | 乙 | 丙 |
c(NO2)/mol ·L-1 | 0.10 | 0.20 | 0.20 |
c(SO2)/mol ·L-1 | 0.10 | 0.10 | 0.20 |
A.平衡时,乙中SO2的转化率大于50%
B.当反应平衡时,丙中c(SO2)是甲中的2倍
C.温度升至90℃,上述反应平衡常数为25/16,则正反应为吸热反应
D.其他条件不变,若起始时向容器乙中充入0.10mol ·L-1 NO2和0.20 mol ·L-1 SO2,达到平衡时c(NO)与原平衡不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A. 向四羟基合铝酸钠溶液中滴加过量的碳酸氢钠溶液:[Al(OH)4]—+4H+=Al3++2H2O
B. 将少量SO2气体通入足量的NaClO溶液中:SO2+2ClO-+H2O=SO32-+2HClO
C. NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH—=BaSO4↓+2H2O
D. 向沸水中滴加饱和氯化铁溶液:Fe3++3H2O=Fe(OH)3↓+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气与适量氯气混合反应可生成NH4Cl(俗称脑砂)和一种无污染的气体。某学习小组利用下列装置模拟该反应,请回答相关问题。

(1)该实验中所需的氯气是用浓盐酸与MnO2反应制取。装置A中仪器X的名称为____;X中发生反应的离子方程式为_______。
(2)要得到干燥纯净的氯气,上述A、B、C装置的连接顺序依次为a→_____(用小写字母表示)。
(3)利用E装置,将适量氨气与氯气充分混合反应氨气应从_______(用小写字母表示)通入,反应的化学方程式为_______________;可能观察到的现象是___________。
(4)《唐本草》记载脑砂入药可以散瘀消肿,天然脑砂含少量NH4Cl,现取天然脑砂进行NH4Cl含量测定。准确称取一定质量脑砂,与足量的氧化铜混合,如下图所示进行实验。已知:2NH4Cl+3CuO=3Cu+N2+2HCl+3H2O 。
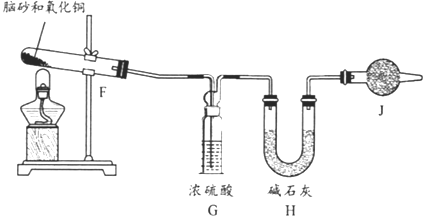
①为顺利完成有关物理量的测定,请完善下列表格:
测量时间点 | 加热前 | 当观察到_____现象时 |
测量内容 | _______________ | 停止加热,冷却,称量H装置的总质量 |
②如果不用J装置,测出NH4Cl的含量将_____(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应N2(g)+3H2(g)![]() 2NH3(g),某温度下,向体积固定的1L密闭容器中充入1mol N2(g)和3mol H2(g),测得不同时刻反应前后的压强关系如下表所示:
2NH3(g),某温度下,向体积固定的1L密闭容器中充入1mol N2(g)和3mol H2(g),测得不同时刻反应前后的压强关系如下表所示:
时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
压强比值P后/P前 | 0.98 | 0.88 | 0.80 | 0.75 | 0.75 | 0.75 |
(1)0~15min内,用H2表示的平均反应速率为v(H2) =___________________mol·L-1·min-1。
(2)达到平衡时N2的转化率为________,该温度下的平衡常数为___________(保留两位小数)。
(3)已知该反应为放热反应,下图为不同条件下反应速率随时间的变化情况(每次仅改变一个条件):a时改变的条件可能是____________;b时改变的条件可能是_______________。

(4)一定条件下的密闭容器中,该反应达到平衡后要提高H2的转化率,可以采取的措施有(_________)
A.低温低压 B.加入催化剂 C.增加N2的浓度 D.增加H2的浓度 E.分离出NH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com