
【题目】氯氧化铜[xCuO·yCuCl2·zH2O]在农业上用作杀菌剂。工业上用铜矿粉(主要含Cu2(OH)2CO3、Fe3O4等)为原料制取氯氧化铜的流程如下:

⑴“调节pH”并生成Fe(OH)3时反应的离子方程式为______。
⑵调节pH,要使常温溶液中c(Cu2+)≥0.022mol·L-1,而c(Fe3+)≤1×10-6mol·L-1,则应调节pH的范围为______。{已知Ksp[Cu(OH)2=2.2×10-20],Ksp[Fe(OH)3=1×10-36]}
⑶为测定氯氧化铜的组成,现进行如下实验:
步骤Ⅰ:称取0.4470 g氯氧化铜,放入锥形瓶,加入一定量30%的硝酸使固体完全溶解。滴加K2CrO4溶液作指示剂,用0.1000mol·L-1 AgNO3标准溶液滴定溶液中的Cl-,滴定至终点时消耗AgNO3标准溶液20.00 mL;
步骤Ⅱ:称取0.4470g氯氧化铜,放入锥形瓶,加入一定量硫酸使固体完全溶解。向溶液中加入过量的KI固体,充分反应后向溶液中滴入数滴淀粉溶液,用0.2000mol·L-1Na2S2O3标准溶液滴定,滴定至终点时消耗Na2S2O3标准溶液20.00mL。
已知步骤Ⅱ中所发生的反应如下:
2Cu2++4I-=2CuI↓+I2 2Na2S2O3+I2=2NaI+Na2S4O6
①已知Ag2CrO4为砖红色沉淀,步骤Ⅰ滴定终点时的实验现象是_______。
②通过计算确定氯氧化铜的化学式________________(写出计算过程)。
【答案】4Fe3++3Cu2(OH)2CO3+3H2O=4Fe(OH)3+6Cu2++3CO2↑ [4,5] 当加入最后一滴AgNO3溶液时,出现砖红色沉淀 3CuO·CuCl2·4H2O
【解析】
铜矿粉溶于盐酸溶液中,含有Cu2+、Fe2+、Fe3+,加双氧水将Fe2+氧化成Fe3+,此时溶液中存在着Fe3+的水解平衡,加入碱式碳酸铜调节pH值,使Fe3+转化成沉淀除去。加入石灰乳将Cu2+沉淀: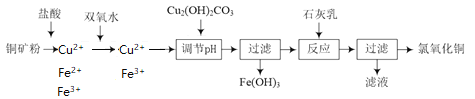
(1)Fe3+水解平衡:Fe3++3H2O![]() Fe(OH)3+3H+,Cu2(OH)2CO3消耗H+, H+浓度减小使平衡正向移动, Fe3+转化成氢氧化铁沉淀而除去,Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O,将俩方程式加和就得到了:4Fe3++3Cu2(OH)2CO3+3H2O=4Fe(OH)3+6Cu2++3CO2↑。
Fe(OH)3+3H+,Cu2(OH)2CO3消耗H+, H+浓度减小使平衡正向移动, Fe3+转化成氢氧化铁沉淀而除去,Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O,将俩方程式加和就得到了:4Fe3++3Cu2(OH)2CO3+3H2O=4Fe(OH)3+6Cu2++3CO2↑。
(2)使溶液中的Fe3+完全变成沉淀时的pH计算:Ksp[Fe(OH)3]=1×10-36=c(Fe3+)×c3(OH—),c(Fe3+)=1×10-6molL—1,解得c(OH—)=1×10—10molL—1,pH=4;使常温溶液中c(Cu2+)≥0.022mol·L-1 pH计算:Ksp[Cu (OH)2]=2.2×10—20=c(Cu2+)×c2(OH—),c(Cu2+)=0.022molL—1,解得c(OH—)=1×10—9molL—1,pH=5;故pH 范围:[4,5]。
(3)①当氯离子已沉淀完全,多加入一滴AgNO3溶液时,CrO42—开始沉淀出现砖红色。
②n(Cl—)=n(AgNO3)=0.1000 mol·L-1×0.02 L=0.002 mol,由方程式知:Cu2+ ~ Na2S2O3,n(Cu2+ ) = n(Na2S2O3)= 0.2000 mol·L-1×0.02 L=0.004 mol,结合氯氧化铜化学式[xCuO·yCuCl2·zH2O]得:n(CuO)= 0.003 mol,n(CuCl2)= 0.001 mol,
n(H2O)=![]() = 0.004 mol,n(CuO):n(CuCl2):n(H2O)=x:y:z=3:1:4,故氯氧化铜的化学式:3CuO·CuCl2·4H2O
= 0.004 mol,n(CuO):n(CuCl2):n(H2O)=x:y:z=3:1:4,故氯氧化铜的化学式:3CuO·CuCl2·4H2O


科目:高中化学 来源: 题型:
【题目】在25℃时,将1.0L c mol·L-1 CH3COOH溶液与0.1mol NaOH固体混合,使之充分反应。然后向该混合溶液中通入HCl气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量的变化如图所示。下列叙述错误的是( )
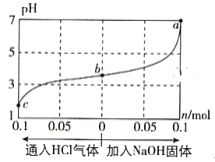
A. 水的电离程度:a>b>c
B. c点对应的混合溶液中:c(CH3COOH)>c(Na+)>c(OH-)
C. a点对应的混合溶液中:c(Na+)=c(CH3COO-)
D. 该温度下,CH3COOH的电离平衡常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业是一种高耗能产业,一种将燃料电池与电解池组合的新工艺可节能30%以上,下图是该工艺图示(电极未标出)。
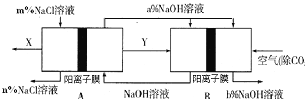
下列说法正确的是
A.X为H2,Y为Cl2
B.A池为电解池,且m<n
C.B池为燃料电池,且a<b
D.该工艺优点是燃料电池提供电能且能提高烧碱产品的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】位于不同主族的四种短周期元素甲、乙、丙、丁,其原子序数依次增大,原子半径r(丁)>r(乙)>r(丙)>r(甲)。四种元素中,只有一种为金属元素,乙和丙原子的最外层电子数之和为丁原子的最外层电子数的3倍。据此推断,下述正确的是
A.简单氢化物的沸点:乙>丙
B.由甲、乙两元素组成的化合物溶于水呈碱性
C.丙和丁两元素的最高价氧化物的水化物之间能发生反应
D.由甲和丙两元素组成的分子,不可能含非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物阿佐昔芬G主要用于防治骨质疏松症和预防乳腺癌。合成路线如下:

⑴A中官能团的名称为_______;B→C的反应类型是_______。
⑵试剂M的分子式为C7H8OS,写出M的结构简式_______。
⑶D的一种同分异构体X同时满足下列条件,写出X的结构简式:______。
Ⅰ.能与FeCl3溶液发生显色反应,1 mol X最多可以消耗足量溴水中1 mol Br2;
Ⅱ.核磁共振氢谱上有4种不同化学环境的氢原子。
⑷![]() 是合成所需的原料之一,它的一种同分异构体Y同时满足下列条件,写出Y的结构简式:_______。
是合成所需的原料之一,它的一种同分异构体Y同时满足下列条件,写出Y的结构简式:_______。
Ⅰ.属于α-氨基酸; Ⅱ.含苯环,核磁共振氢谱上有6种不同化学环境的氢原子。
⑸请以CH2=CH2和![]() 为原料制备
为原料制备 的合成路线图____________________。(无机试剂任用,合成路线图示例见题干)
的合成路线图____________________。(无机试剂任用,合成路线图示例见题干)
⑹已知:![]() 。请写出以
。请写出以 和CH3Br为原料制备
和CH3Br为原料制备 的合成路线图______________________________________。(无机试剂任用,合成路线图示例见题干)。
的合成路线图______________________________________。(无机试剂任用,合成路线图示例见题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫能起漂白、保鲜作用,使物品颜色显的白亮、鲜艳。如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。下列有关说法正确的是
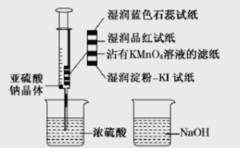
A.蓝色石蕊试纸变红后褪色
B.NaOH溶液可用于除去实验中多余的SO2
C.湿润淀粉-KI试纸未变蓝,说明SO2有还原性
D.品红试纸、沾有KMnO4溶液滤纸均褪色,证明了SO2的漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解)。
(1)实验原理:
①Al4C3与硫酸反应可生成CH4;
②AIN溶于强酸产生铵盐,溶于强碱生成氨气,请写出AlN与NaOH溶液反应的化学方程式:__________________________________________________________________
(2)实验装置(如图所示,量气管为碱式滴定管改装)
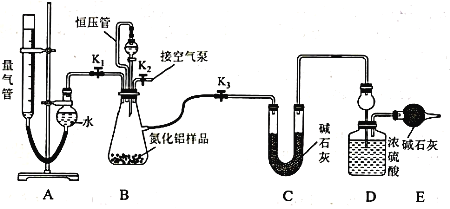
连好装置后,首先应进行的操作是_____________________________________ 。
(3)实验过程:称得装置D的初始质量为y g;称取x g AlN样品置于装置B锥形瓶中,各装置中加入相应药品,重新连好装置;读取量气管的初始读数为a mL(量气装置左右液面相平)。
①欲首先测量Al4C3质量分数的有关数据,对K1、K2、K3三个活塞的操作是关闭活塞_______,打开活塞______。
②若无恒压管,对所测气体体积的影响是_______(填“偏大”、“偏小”或“无影响”)。
③量气管中液面不再发生变化,说明反应已经结束。读取读数之前,应对量气管进行的操作为 ______________________________________ ;若量气管中的液面高于右侧球形容器中的液面,所测气体的体积_________(填“偏大”、“偏小”或“无影响”)。
④记录滴定管的读数为b mL(已知:该实验条件下的气体摩尔体积为Vm L· mol-1),则Al4C3的质量分数为___________(用可能含a、b、x、y、Vm的代数式表示)。
⑤测量AlN质量分数的数据:首先关闭活塞K1,打开活塞K3,通过分液漏斗加入过量NaOH溶液,与装置B瓶内物质充分反应;反应完成后,___________________________(填该步应进行的操作),最后称得装置D的质量为z g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮族元素有关物质的结构、性质和转化有重要意义。
⑴已知P4、P4O6的结构及所含化学键键能如下:
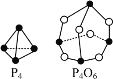
化学键 | P-P | P-O | O=O |
键能(kJ·mol-1) | a | b | c |
则P4燃烧的热化学反应方程式:P4(s)+3O2(g)=P4O6(s) ΔH=_______kJ·mol-1。
⑵亚磷酸(H3PO3) 是一种精细化工产品。已知25℃时,亚磷酸(H3PO3)的Ka1=5×10-2,Ka2=2.5×10-7。0.1 mol·L-1 NaH2PO3溶液中H3PO3、H2PO![]() 、HPO
、HPO![]() 的浓度由大到小的顺序是_______。
的浓度由大到小的顺序是_______。
⑶雌黄(As2S3)和雄黄(As4S4)早期都曾用作绘画颜料,又都因有抗病毒疗效而用来入药。一定条件下,雌黄和雄黄的转化关系如图1所示。
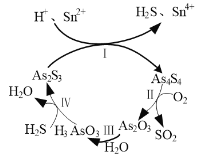
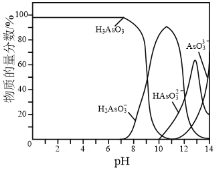
图1 图2
①反应Ⅰ的离子方程式为______。
②反应Ⅱ中,若1 mol As4S4参加反应,转移电子的物质的量为______。
⑷常温下,用NaOH溶液滴定H3AsO3溶液,含As微粒的物质的量分数随pH的变化如图2所示。
①将NaOH溶液滴加到滴有酚酞的H3AsO3溶液中,当溶液由无色变为红色时主要反应的离子方程式为______。
②一定条件下H3AsO3可发生如下反应: H3AsO3+I2+H2O![]() H3AsO4+2H++2I-利用该反应可设计如图所示的原电池。负极的电极反应式为_______。当反应达到平衡后,向甲中加
H3AsO4+2H++2I-利用该反应可设计如图所示的原电池。负极的电极反应式为_______。当反应达到平衡后,向甲中加
入NaOH,盐桥中阴离子_______(填“向甲池”、 “向乙池”或“不”)移动。
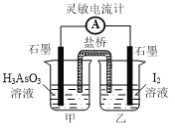
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯是石油化工的重要原料,一定条件下可发生下列转化:
已知:![]()
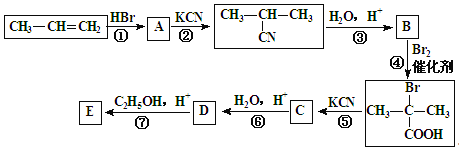
(1)A的结构简式为:______________________;
(2)反应④的类型为:______________________反应;
(3) D与足量乙醇反应生成E的化学方程式为:______________________________________。
(4)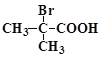 与足量NaOH溶液反应的化学方程式为___________________________。
与足量NaOH溶液反应的化学方程式为___________________________。
(5)B的同分异构体有多种.写出其中既能发生银镜反应,又能发生酯化反应的2种同分异构体的结构简式:___________________________、_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com