
【题目】药物阿佐昔芬G主要用于防治骨质疏松症和预防乳腺癌。合成路线如下:

⑴A中官能团的名称为_______;B→C的反应类型是_______。
⑵试剂M的分子式为C7H8OS,写出M的结构简式_______。
⑶D的一种同分异构体X同时满足下列条件,写出X的结构简式:______。
Ⅰ.能与FeCl3溶液发生显色反应,1 mol X最多可以消耗足量溴水中1 mol Br2;
Ⅱ.核磁共振氢谱上有4种不同化学环境的氢原子。
⑷![]() 是合成所需的原料之一,它的一种同分异构体Y同时满足下列条件,写出Y的结构简式:_______。
是合成所需的原料之一,它的一种同分异构体Y同时满足下列条件,写出Y的结构简式:_______。
Ⅰ.属于α-氨基酸; Ⅱ.含苯环,核磁共振氢谱上有6种不同化学环境的氢原子。
⑸请以CH2=CH2和![]() 为原料制备
为原料制备 的合成路线图____________________。(无机试剂任用,合成路线图示例见题干)
的合成路线图____________________。(无机试剂任用,合成路线图示例见题干)
⑹已知:![]() 。请写出以
。请写出以 和CH3Br为原料制备
和CH3Br为原料制备 的合成路线图______________________________________。(无机试剂任用,合成路线图示例见题干)。
的合成路线图______________________________________。(无机试剂任用,合成路线图示例见题干)。
【答案】羧基 取代反应 ![]()
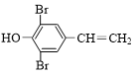
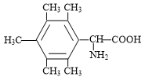
![]()


【解析】
(1)A中官能团的名称为羧基;观察B、C的结构简式B与溴苯各少了一个氯原子和氢原子,生成了C和HCl,故发生了取代反应。
(2)![]() 中,右边来源于D,少了1个Br原子,左边来源于试剂M,结合M的分子式,故M为
中,右边来源于D,少了1个Br原子,左边来源于试剂M,结合M的分子式,故M为![]() 。
。
(3)D的分子式为C8H6OBr2,不饱和度是5,同分异构体X能与FeCl3溶液发生显色反应,说明有苯环(4个不饱和度)、酚-OH,还有1个不饱和度为碳碳双键,1 mol X最多可以消耗足量溴水中1 mol Br2,碳碳双键被加成,说明酚-OH邻对位全被取代基占了,核磁共振氢谱上有4种不同化学环境的氢原子,说明结构对称,碳碳双键在酚-OH对位,故同分异构体X为 。
。
(4)![]() 有13个C,不饱和度为5,同分异构体属于α-氨基酸,有-NH2,-COOH(1个不饱和度), 13个C含苯环(4个不饱和度),核磁共振氢谱上有6种不同化学环境的氢原子,结构对称,故同分异构体Y为
有13个C,不饱和度为5,同分异构体属于α-氨基酸,有-NH2,-COOH(1个不饱和度), 13个C含苯环(4个不饱和度),核磁共振氢谱上有6种不同化学环境的氢原子,结构对称,故同分异构体Y为 。
。
(5)观察![]() 和目标产物
和目标产物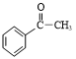 ,可以发现这是一个增长碳链的反应,根据题目给出的增长碳链的信息:
,可以发现这是一个增长碳链的反应,根据题目给出的增长碳链的信息: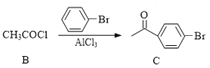 ,确定思路:由乙烯先制CH3COCl,再与苯发生类似B→C的反应即可制得,合成路线为
,确定思路:由乙烯先制CH3COCl,再与苯发生类似B→C的反应即可制得,合成路线为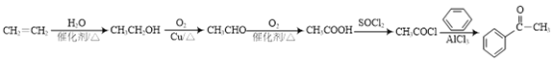
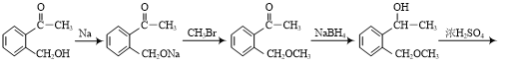
(6)由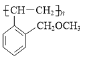 倒推其单体是
倒推其单体是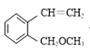 ,联系反应物
,联系反应物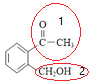 和CH3Br,可以看出这里涉及两个位置1部分变碳碳双键,2部分引入-CH3成醚键。1部分根据信息
和CH3Br,可以看出这里涉及两个位置1部分变碳碳双键,2部分引入-CH3成醚键。1部分根据信息![]() 知:1先在NaBH/span>4存在下酮基成醇羟基,然后再消去成烯;2部位卤代烃可以和醇钠发生取代反应成醚,故先将醇与金属Na反应制醇钠。
知:1先在NaBH/span>4存在下酮基成醇羟基,然后再消去成烯;2部位卤代烃可以和醇钠发生取代反应成醚,故先将醇与金属Na反应制醇钠。
 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为元素周期表中前四周期元素,且原子序数依次增大,A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C的氧化物是导致酸雨的主要物质之一,D原子核外电子有8种不同的运动状态,E的基态原子在前四周期元素的基态原子中单电子数最多,F元素的基态原子最外能层只有一个电子,其他能层均已充满电子。
(1)写出基态E原子的价电子排布式_______。
(2)A与C可形成CA3分子,该分子中C原子的杂化类型为______,该分子的立体结构为_____;C的单质与BD化合物是等电子体,据等电子体的原理,写出BD化合物的电子式______;A2D由液态形成晶体时密度减小,其主要原因是__________(用文字叙述)。
(3)已知D、F能形成一种化合物,其晶胞的结构如图所示,则该化合物的化学式为___;若相邻D原子和F原子间的距离为a cm,阿伏加德罗常数的值为![]() NA,则该晶体的密度为______g·cm-3(用含a、NA的式子表示)。
NA,则该晶体的密度为______g·cm-3(用含a、NA的式子表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于化学方程式SiO2+3C![]() SiC+2CO↑,有关叙述正确的是
SiC+2CO↑,有关叙述正确的是
A. 反应中SiO2是氧化剂,C是还原剂
B. 硅元素被还原了,碳元素被氧化了
C. 在反应中C既是氧化剂又是还原剂
D. 在反应中氧化剂与还原剂的物质的量之比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2A是二元弱酸,25℃时,配制一组c(H2A)+c(HA-)+c(A2-)=0.1mol·L-1的H2A和NaOH混合溶液,溶液中H2A、HA-和A2-所占三种粒子总数的物质的量分数(α)随溶液pH变化的关系如图所示。下列说法正确的是
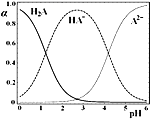
A.c(Na+)=0.1mol·L-1的溶液中:c(H+)=c(A2-)+c(OH-)-c(H2A)
B.c (HA-)=c(A2-)的溶液中:c(Na+)>3c(A2-)
C.c (HA-)=0.5mol·L-1的溶液中:2c(H2A)+c(H+)=c(OH-)+1.5mol·L-1
D.pH=2的溶液中:c(HA-)+2c(A2-)<0.1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构为下图所示,这种有机物不可能具有的性质是( )
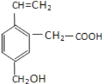
①所有碳原子可能共面;
②能使酸性KMnO4 溶液和溴水褪色,且原理相同;
③1mol 该有机物分别与足量 Na 或NaHCO3 反应,产生气体在标况下体积不相等;
④能发生酯化反应;
⑤能发生加聚反应;
⑥1mol 该有机物完全燃烧生成 CO2 和H2O 消耗 O2 的体积为 280L(标准状况)
A.①②B.②⑥C.③⑥D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯氧化铜[xCuO·yCuCl2·zH2O]在农业上用作杀菌剂。工业上用铜矿粉(主要含Cu2(OH)2CO3、Fe3O4等)为原料制取氯氧化铜的流程如下:

⑴“调节pH”并生成Fe(OH)3时反应的离子方程式为______。
⑵调节pH,要使常温溶液中c(Cu2+)≥0.022mol·L-1,而c(Fe3+)≤1×10-6mol·L-1,则应调节pH的范围为______。{已知Ksp[Cu(OH)2=2.2×10-20],Ksp[Fe(OH)3=1×10-36]}
⑶为测定氯氧化铜的组成,现进行如下实验:
步骤Ⅰ:称取0.4470 g氯氧化铜,放入锥形瓶,加入一定量30%的硝酸使固体完全溶解。滴加K2CrO4溶液作指示剂,用0.1000mol·L-1 AgNO3标准溶液滴定溶液中的Cl-,滴定至终点时消耗AgNO3标准溶液20.00 mL;
步骤Ⅱ:称取0.4470g氯氧化铜,放入锥形瓶,加入一定量硫酸使固体完全溶解。向溶液中加入过量的KI固体,充分反应后向溶液中滴入数滴淀粉溶液,用0.2000mol·L-1Na2S2O3标准溶液滴定,滴定至终点时消耗Na2S2O3标准溶液20.00mL。
已知步骤Ⅱ中所发生的反应如下:
2Cu2++4I-=2CuI↓+I2 2Na2S2O3+I2=2NaI+Na2S4O6
①已知Ag2CrO4为砖红色沉淀,步骤Ⅰ滴定终点时的实验现象是_______。
②通过计算确定氯氧化铜的化学式________________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组在实验室用乙醇、浓硫酸和溴化钠和水混合反应来制备溴乙烷,并探究溴乙烷的性质。有关数据见下表:
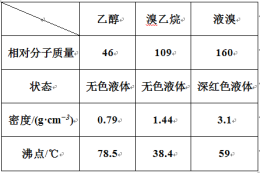
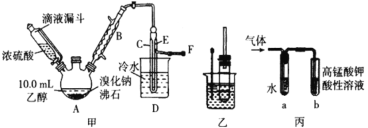
I. 溴乙烷的制备
反应原理如下,实验装置如上图(加热装置、夹持装置均省略):
H2SO4+NaBr ![]() NaHSO4+HBr↑ CH3CH2OH+HBr
NaHSO4+HBr↑ CH3CH2OH+HBr ![]() CH3CH2Br+H2O
CH3CH2Br+H2O
(1) 图甲中A 仪器的名称_____,图中B 冷凝管的作用为_____。
(2) 若图甲中A 加热温度过高或浓硫酸的浓度过大,均会使 C 中收集到的粗产品呈橙色,原因是A 中发生了副反应生成了_____;F 连接导管通入稀NaOH 溶液中,其目的主要是吸收_____等尾气防止污染空气
II. 溴乙烷性质的探究
用如图实验装置验证溴乙烷的性质:
(3) 在乙中试管内加入 10mL6mol·L -1NaOH 溶液和 2mL 溴乙烷,振荡、静置,液体分层,水浴加热。该过程中的化学方程式为_______。
(4) 若将乙中试管里的 NaOH 溶液换成NaOH 乙醇溶液,为证明产物为乙烯,将生成的气体通入如图丙装置。a 试管中的水的作用是_______;若无 a 试管,将生成的气体直接通入 b 试管中,则 b中的试剂可以为 _____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】波立维是国家刚刚引进的新药,它给中风、心肌梗死等心脏病患者带来福音。波立维属于硫酸氢盐,它的结构如图所示。下列关于它的说法正确的是()
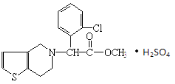
A.该物质的化学式为C16H15ClNO2·H2SO4
B.1mol该物质最多可与6mol氢气反应
C.波立维能形成硫酸氢盐是与其结构中的氮原子有关
D.该有机物可以发生氧化、还原、加成、取代、消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CCTV在“新闻30分”中介绍:王者归“铼”,我国发现超级铼矿,飞机上天全靠它。铼的稳定硫化物有ReS2,稳定的氧化物有Re2O7。工业上,常从冶炼铜的废液中提取铼,其简易工艺流程如下(部分副产物省略,铼在废液中以ReO4-形式存在):
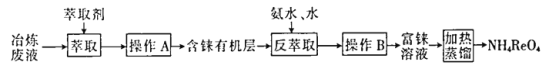
回答下列问题:
(1)NH4ReO4(高铼酸铵)中铼元素化合价为_________________。
(2)操作A的名称是_____________。
“萃取”中萃取剂应具有的性质:______(填代号)。
①萃取剂难溶于水 ②萃取剂的密度大于水
③ReO4-在萃取剂中的溶解度大于在水中的溶解度 ④萃取剂不和ReO4-发生反应
(3)在“反萃取”中,加入氨水、水的目的是_________________。
(4)在高温下高铼酸铵分解生成Re2O7,用氢气还原Re2O7,制备高纯度铼粉。
①写出高铼酸铵分解生成Re2O7的化学方程式_____________________。
②工业上,利用氢气还原Re2O7制备铼,根据生成铼的量计算氢气量,实际消耗H2量大于理论计算量,其原因是_____________________。
(5)工业上,高温灼烧含ReS2的矿粉,可以制备R2O7。以含ReS2的矿石原料生产48.4tRe2O7,理论上转移__________mol电子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com