
【题目】波立维是国家刚刚引进的新药,它给中风、心肌梗死等心脏病患者带来福音。波立维属于硫酸氢盐,它的结构如图所示。下列关于它的说法正确的是()
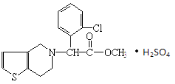
A.该物质的化学式为C16H15ClNO2·H2SO4
B.1mol该物质最多可与6mol氢气反应
C.波立维能形成硫酸氢盐是与其结构中的氮原子有关
D.该有机物可以发生氧化、还原、加成、取代、消去反应
科目:高中化学 来源: 题型:
【题目】利用废旧镀锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO,制备流程图如下:
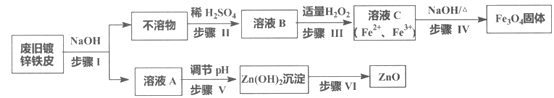
已知反应:①Zn+2NaOH=Na2ZnO2+H2↑ ②Zn(OH)2+2NaOH=Na2ZnO2+2H2O
回答下列问题:
(1)步骤I中的分离操作名称是_______,溶液A中的溶质有_______(填化学式)。
(2)步骤III中反应的离子方程式是___________________________________。
(3)步骤IV中反应的离子方程式是____________________________。
(4)步骤V可选用的试剂是_______(填序号)。
a. NaOH溶液 b. 氨水 c. 盐酸
(5)步骤VI的实验操作是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物阿佐昔芬G主要用于防治骨质疏松症和预防乳腺癌。合成路线如下:

⑴A中官能团的名称为_______;B→C的反应类型是_______。
⑵试剂M的分子式为C7H8OS,写出M的结构简式_______。
⑶D的一种同分异构体X同时满足下列条件,写出X的结构简式:______。
Ⅰ.能与FeCl3溶液发生显色反应,1 mol X最多可以消耗足量溴水中1 mol Br2;
Ⅱ.核磁共振氢谱上有4种不同化学环境的氢原子。
⑷![]() 是合成所需的原料之一,它的一种同分异构体Y同时满足下列条件,写出Y的结构简式:_______。
是合成所需的原料之一,它的一种同分异构体Y同时满足下列条件,写出Y的结构简式:_______。
Ⅰ.属于α-氨基酸; Ⅱ.含苯环,核磁共振氢谱上有6种不同化学环境的氢原子。
⑸请以CH2=CH2和![]() 为原料制备
为原料制备 的合成路线图____________________。(无机试剂任用,合成路线图示例见题干)
的合成路线图____________________。(无机试剂任用,合成路线图示例见题干)
⑹已知:![]() 。请写出以
。请写出以 和CH3Br为原料制备
和CH3Br为原料制备 的合成路线图______________________________________。(无机试剂任用,合成路线图示例见题干)。
的合成路线图______________________________________。(无机试剂任用,合成路线图示例见题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解)。
(1)实验原理:
①Al4C3与硫酸反应可生成CH4;
②AIN溶于强酸产生铵盐,溶于强碱生成氨气,请写出AlN与NaOH溶液反应的化学方程式:__________________________________________________________________
(2)实验装置(如图所示,量气管为碱式滴定管改装)
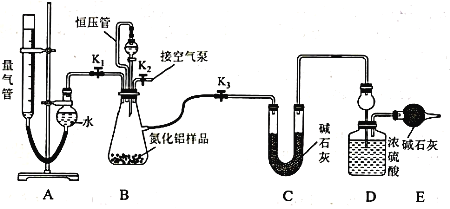
连好装置后,首先应进行的操作是_____________________________________ 。
(3)实验过程:称得装置D的初始质量为y g;称取x g AlN样品置于装置B锥形瓶中,各装置中加入相应药品,重新连好装置;读取量气管的初始读数为a mL(量气装置左右液面相平)。
①欲首先测量Al4C3质量分数的有关数据,对K1、K2、K3三个活塞的操作是关闭活塞_______,打开活塞______。
②若无恒压管,对所测气体体积的影响是_______(填“偏大”、“偏小”或“无影响”)。
③量气管中液面不再发生变化,说明反应已经结束。读取读数之前,应对量气管进行的操作为 ______________________________________ ;若量气管中的液面高于右侧球形容器中的液面,所测气体的体积_________(填“偏大”、“偏小”或“无影响”)。
④记录滴定管的读数为b mL(已知:该实验条件下的气体摩尔体积为Vm L· mol-1),则Al4C3的质量分数为___________(用可能含a、b、x、y、Vm的代数式表示)。
⑤测量AlN质量分数的数据:首先关闭活塞K1,打开活塞K3,通过分液漏斗加入过量NaOH溶液,与装置B瓶内物质充分反应;反应完成后,___________________________(填该步应进行的操作),最后称得装置D的质量为z g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。
![]()
(1)写出A、B、C三元素的元素符号_____、_____、_____。
(2)C在元素周期表中的位置是_____。
(3)B的原子结构示意图为_____,C的氢化物与B的氢化物的稳定性强弱顺序为_____(填化学式)。
(4)比较A、C的原子半径:A_____C,写出A的气态氢化物与A的最高价氧化物对应水化物反应的化学方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮族元素有关物质的结构、性质和转化有重要意义。
⑴已知P4、P4O6的结构及所含化学键键能如下:
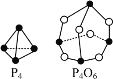
化学键 | P-P | P-O | O=O |
键能(kJ·mol-1) | a | b | c |
则P4燃烧的热化学反应方程式:P4(s)+3O2(g)=P4O6(s) ΔH=_______kJ·mol-1。
⑵亚磷酸(H3PO3) 是一种精细化工产品。已知25℃时,亚磷酸(H3PO3)的Ka1=5×10-2,Ka2=2.5×10-7。0.1 mol·L-1 NaH2PO3溶液中H3PO3、H2PO![]() 、HPO
、HPO![]() 的浓度由大到小的顺序是_______。
的浓度由大到小的顺序是_______。
⑶雌黄(As2S3)和雄黄(As4S4)早期都曾用作绘画颜料,又都因有抗病毒疗效而用来入药。一定条件下,雌黄和雄黄的转化关系如图1所示。
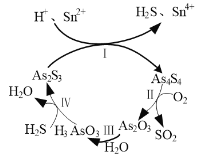
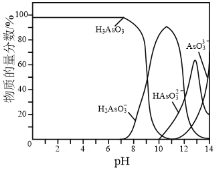
图1 图2
①反应Ⅰ的离子方程式为______。
②反应Ⅱ中,若1 mol As4S4参加反应,转移电子的物质的量为______。
⑷常温下,用NaOH溶液滴定H3AsO3溶液,含As微粒的物质的量分数随pH的变化如图2所示。
①将NaOH溶液滴加到滴有酚酞的H3AsO3溶液中,当溶液由无色变为红色时主要反应的离子方程式为______。
②一定条件下H3AsO3可发生如下反应: H3AsO3+I2+H2O![]() H3AsO4+2H++2I-利用该反应可设计如图所示的原电池。负极的电极反应式为_______。当反应达到平衡后,向甲中加
H3AsO4+2H++2I-利用该反应可设计如图所示的原电池。负极的电极反应式为_______。当反应达到平衡后,向甲中加
入NaOH,盐桥中阴离子_______(填“向甲池”、 “向乙池”或“不”)移动。
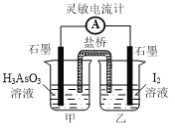
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,反应CCl4(g)+H2(g)![]() CHCl3(g)+HCl(g) ,可使CCl4(沸点77 ℃)转化为重要的化工原料CHCl3(沸点61.2 ℃),可减少其对臭氧层的破坏。(已知:该反应的副反应会生成CH2Cl2、CH3Cl和CH4等)
CHCl3(g)+HCl(g) ,可使CCl4(沸点77 ℃)转化为重要的化工原料CHCl3(沸点61.2 ℃),可减少其对臭氧层的破坏。(已知:该反应的副反应会生成CH2Cl2、CH3Cl和CH4等)
(1)CH4与Cl2反应时,每生成1molCCl4(g)或1molCHCl3(g)的焓变分别是△H1和△H2;H2在Cl2中燃烧,每生成1molHCl(g)产生的焓变为△H3,则:CCl4(g)+H2(g)![]() CHCl3(g)+HCl(g)的△H=_____(用含有△H1、△H2和△H3的算式表示)
CHCl3(g)+HCl(g)的△H=_____(用含有△H1、△H2和△H3的算式表示)
(2)在密闭容器中,CCl4+H2![]() CHCl3+HCl达到平衡状态后,测得如下数据(假设不考虑副反应)。
CHCl3+HCl达到平衡状态后,测得如下数据(假设不考虑副反应)。
实验序号 | 温度/℃ | 初始CCl4浓度/(mol·L-1) | 初始H2浓度/(mol·L-1) | CCl4的平衡转化率 |
1 | 110 | 0.8 | 1.2 | α1 |
2 | 110 | 1 | 1 | 50% |
3 | 100 | 1 | 1 | α3 |
①实验1中,CCl4的转化率α1_____50%(填“大于”“小于”或“等于”)。
②实验2中,反应进行到10h时达到平衡,在这10h内,H2的平均反应速率为_____mol· L-1·min-1。
③110 ℃时,该反应的化学平衡常数的数值为________。
④实验3中,α3的值________。
A. 等于50% B.大于50% C.小于50% D.依题所给信息无法判断

①图中表示H2起始浓度为2mol·L-1CHCl3的百分含量的变化曲线是____(填字母)。
②依图可知,有利于提高CCl4的消耗百分率和产物中CHCl3的百分含量H2的起始浓度应该为________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验说法,不正确的是( )
A.碱液不慎溅到手上,先用大量水冲洗,再用饱和硼酸溶液洗,最后用水冲洗
B.![]() 和
和![]() 的混合物经溶解、过滤,洗涤、干燥,可分离出
的混合物经溶解、过滤,洗涤、干燥,可分离出![]()
C.用容量瓶配制溶液,定容时若加水超过刻度线,立即用滴管吸出多余液体
D.火柴头的浸泡液中滴加![]() 溶液,稀
溶液,稀![]() 和
和![]() 溶液,可检验火柴头是否含有氯元素
溶液,可检验火柴头是否含有氯元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,某反应达到了化学平衡,其反应过程对应的能量变化如图。下列说法正确的是
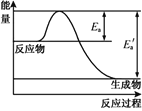
A.Ea为逆反应活化能,E为正反应活化能
B.该反应为放热反应,ΔH=Ea’-Ea
C.所有活化分子的平均能量高于或等于所有分子的平均能量
D.温度升高,逆反应速率加快幅度大于正反应加快幅度,使平衡逆移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com