
【题目】A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。
![]()
(1)写出A、B、C三元素的元素符号_____、_____、_____。
(2)C在元素周期表中的位置是_____。
(3)B的原子结构示意图为_____,C的氢化物与B的氢化物的稳定性强弱顺序为_____(填化学式)。
(4)比较A、C的原子半径:A_____C,写出A的气态氢化物与A的最高价氧化物对应水化物反应的化学方程式:_____。
【答案】N S F 第二周期ⅦA族 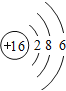 HF>H2S > NH3+ HNO3= NH4NO3
HF>H2S > NH3+ HNO3= NH4NO3
【解析】
A、B、C为短周期元素,由它们在周期表中的位置,可知A、C处于第二周期,B处于第三周期,令A原子核外电子为x,则B质子数为x+9,C核外电子数为x+2,则:x+x+2=x+9,解得x=7,故A为N元素、B为S元素、C为F元素,据此分析。
(1)由上述分析可知,A为N元素、B为S元素、C为F元素,故答案为:N;S;F;
(2)C为F元素,核外电子数为9,有2个电子层,最外层电子数为7,处于第二周期ⅦA族;
(3)B为S元素,原子结构示意图为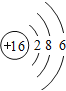 ;C为F元素,非金属性F>S,非金属性越强,气态氢化物的稳定性越强,则氢化物的稳定性强弱顺序为HF>H2S;
;C为F元素,非金属性F>S,非金属性越强,气态氢化物的稳定性越强,则氢化物的稳定性强弱顺序为HF>H2S;
(4)A为N元素、C为F元素,同周期元素从左到右原子半径依次减小,则原子半径N>F;A的气态氢化物为NH3,A的最高价氧化物对应水化物为HNO3,二者反应生成NH4NO3,反应的化学方程式为:NH3+ HNO3= NH4NO3。


科目:高中化学 来源: 题型:
【题目】已知反应 CO(g)+H2O(g)CO2(g)+H2(g) △H = -43kJ·mol-1,在850℃时K=1。今在某密闭容器中充入1.0molCO、3.0molH2O、1.0molCO2和x molH2,下列说法不正确的是
A.900℃ 时,该反应的平衡常数 K<1
B.850℃ 时,若x=5.0,则起始时反应向逆反应方向进行
C.850℃达到化学平衡后,通入CO,化学平衡逆向移动
D.850℃时,若要使上述反应开始时向正反应方向进行,则x 应满足x<3.0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构为下图所示,这种有机物不可能具有的性质是( )
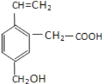
①所有碳原子可能共面;
②能使酸性KMnO4 溶液和溴水褪色,且原理相同;
③1mol 该有机物分别与足量 Na 或NaHCO3 反应,产生气体在标况下体积不相等;
④能发生酯化反应;
⑤能发生加聚反应;
⑥1mol 该有机物完全燃烧生成 CO2 和H2O 消耗 O2 的体积为 280L(标准状况)
A.①②B.②⑥C.③⑥D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组在实验室用乙醇、浓硫酸和溴化钠和水混合反应来制备溴乙烷,并探究溴乙烷的性质。有关数据见下表:
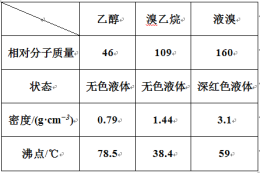
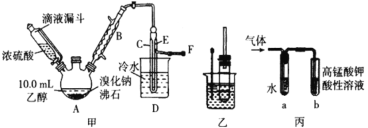
I. 溴乙烷的制备
反应原理如下,实验装置如上图(加热装置、夹持装置均省略):
H2SO4+NaBr ![]() NaHSO4+HBr↑ CH3CH2OH+HBr
NaHSO4+HBr↑ CH3CH2OH+HBr ![]() CH3CH2Br+H2O
CH3CH2Br+H2O
(1) 图甲中A 仪器的名称_____,图中B 冷凝管的作用为_____。
(2) 若图甲中A 加热温度过高或浓硫酸的浓度过大,均会使 C 中收集到的粗产品呈橙色,原因是A 中发生了副反应生成了_____;F 连接导管通入稀NaOH 溶液中,其目的主要是吸收_____等尾气防止污染空气
II. 溴乙烷性质的探究
用如图实验装置验证溴乙烷的性质:
(3) 在乙中试管内加入 10mL6mol·L -1NaOH 溶液和 2mL 溴乙烷,振荡、静置,液体分层,水浴加热。该过程中的化学方程式为_______。
(4) 若将乙中试管里的 NaOH 溶液换成NaOH 乙醇溶液,为证明产物为乙烯,将生成的气体通入如图丙装置。a 试管中的水的作用是_______;若无 a 试管,将生成的气体直接通入 b 试管中,则 b中的试剂可以为 _____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物E(二乙酸-1,4-环己二醇酯)是一种制作建筑材料的原料。其合成路线如下:

完成下列填空:
(1)A中含有的官能团是______;E的分子式是______;试剂a是______。
(2)写出反应类型:B→C______。
(3)C与D反应生成E的化学方程式:______。
(4)C的同分异构体,能使石蕊试剂显红色,写出该物质的一种结构简式______。
(5)设计一条以环己醇(![]() )为原料(其他无机试剂任取)合成A的合成路线。
)为原料(其他无机试剂任取)合成A的合成路线。
(合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)_____________________
目标产物)_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】波立维是国家刚刚引进的新药,它给中风、心肌梗死等心脏病患者带来福音。波立维属于硫酸氢盐,它的结构如图所示。下列关于它的说法正确的是()
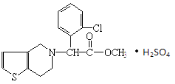
A.该物质的化学式为C16H15ClNO2·H2SO4
B.1mol该物质最多可与6mol氢气反应
C.波立维能形成硫酸氢盐是与其结构中的氮原子有关
D.该有机物可以发生氧化、还原、加成、取代、消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A.向0.1mol![]() CH3COOH溶液中加入少量水,溶液中
CH3COOH溶液中加入少量水,溶液中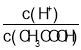 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C.向盐酸中加入氨水至中性,溶液中![]() >1
>1
D.将0.1mol/L的NaOH的温度提高至80℃,溶液的pH变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Ca、Cu、Fe四种金属元素组成。请回答下列问题:
(1)基态铁原子价电子排布式为_________,从结构角度来看,Fe2+易被氧化成Fe3+的原因是________________。
(2)SCN-离子可用于 Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S)。
①写出与 SCN-互为等电子体的一种微粒_____(分子或离子);
②硫氰酸分子中硫原子的杂化方式为_____。
③异硫氰酸的沸点比硫氰酸沸点高的原因是____________________________。
(3)新制的Cu(OH)2可溶于过量的氨水,生成的配合物[Cu(NH3)4](OH)2中含有的化学键类型有 _____________________,1 mol该物质中含有 ____________________个σ键。
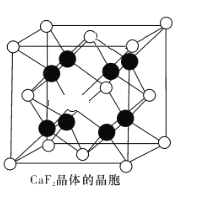
(4)CaF2晶体的晶胞如图所示。已知:CaF2晶体的密度为ρ g·cm-3,NA代表阿伏加德罗常数的值。CaF2晶体中Ca2+和F-之间的最近核间距(d)为 ______________pm(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设[aX+bY]为a个X微粒和b个Y微粒组成的一个微粒集合体,NA为阿伏加德罗常数的值。下列说法不正确的是
A.H2(g)+![]() O2(g)=H2O(l) ΔH=-286 kJ·mol1,则每1 mol [H2(g)+
O2(g)=H2O(l) ΔH=-286 kJ·mol1,则每1 mol [H2(g)+![]() O2(g)]生成1 mol [H2O(l)]放热286 kJ
O2(g)]生成1 mol [H2O(l)]放热286 kJ
B.Cr2O72-+ne+14H+=2Cr3++7H2O,则每生成1 mol Cr3+转移电子数为3NA
C.Al3++4OH=[Al(OH)4],说明1 mol Al(OH)3电离出H+数为NA
D.1 mol CO2与NaOH溶液完全反应,则n(CO32-)+n(HCO3-)+n(H2CO3)=1 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com