
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Ca、Cu、Fe四种金属元素组成。请回答下列问题:
(1)基态铁原子价电子排布式为_________,从结构角度来看,Fe2+易被氧化成Fe3+的原因是________________。
(2)SCN-离子可用于 Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S)。
①写出与 SCN-互为等电子体的一种微粒_____(分子或离子);
②硫氰酸分子中硫原子的杂化方式为_____。
③异硫氰酸的沸点比硫氰酸沸点高的原因是____________________________。
(3)新制的Cu(OH)2可溶于过量的氨水,生成的配合物[Cu(NH3)4](OH)2中含有的化学键类型有 _____________________,1 mol该物质中含有 ____________________个σ键。
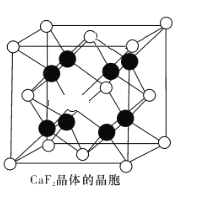
(4)CaF2晶体的晶胞如图所示。已知:CaF2晶体的密度为ρ g·cm-3,NA代表阿伏加德罗常数的值。CaF2晶体中Ca2+和F-之间的最近核间距(d)为 ______________pm(列出计算式即可)。
【答案】3d64s2 Fe3+价电子为3d5半满状态,更稳定 N2O、CO2、CS2、OCN任意一种 sp3 异硫氰酸分子间含有氢键 离子键、共价键、配位键 18NA 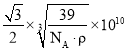
【解析】
(1)基态铁原子的核外电子排布式为[Ar]3d64s2;结合构造原理与洪特规则特例,书写符合条件的元素原子的价电子排布进行判断;
(2)根据洪特规则特例,处于半充满、全充满状态更稳定;
①原子总数相等、价电子总数也相等的微粒互为等电子体,C原子与1个单位负电荷可以等效替换为N原子,N原子与1个单位负电荷可以替换为O原子,S原子可以用氧原子替换;
②单键为σ键,三键含有1个σ键、2个π键;HSCN分子中分子结构式为HSC≡N,每个S原子价层电子对个数是4且含有两个孤电子对,根据价层电子对互斥理论判断硫原子的杂化方式;
③分子间形成氢键的物质,沸点更高;
(3)根据分子的结构所以含有的化学键离子键、共价键、配位键,得出σ键的数目;
(4)则氟离子和钙离子之间的最小距离就是该晶胞体对角线的![]() ,根据密度公式,算出体积,再算出晶胞的边长,再算出对角线的长度,从而得出距离。
,根据密度公式,算出体积,再算出晶胞的边长,再算出对角线的长度,从而得出距离。
(1)26号铁元素的基态原子的原子核外电子排布式是1s22s22p63s23p63d64s2,基态铁原子价电子排布式为3d64s2,可知在3d轨道上存在4个未成对电子;失去电子变成铁离子时,先失去4s轨道上的2个电子,后失去3d轨道上的1个电子,Fe2+价电子为3d6,失去电子形成更稳定的3d5半满状态的Fe3+,Fe2+ 易被氧化成Fe3+,
故答案为:3d64s2;Fe3+价电子为3d5半满状态,更稳定;
(2)①C原子与1个单位负电荷可以等效替换为N原子,N原子与1个单位负电荷可以替换为O原子,S原子可以用氧原子替换,与SCN互为等电子体的一种微粒为:N2O、CO2、CS2、OCN,
故答案为:N2O、CO2、CS2、OCN任意一种;
② HSCN分子中分子结构式为HSC≡N,每个S原子价层电子对个数是4且含有两个孤电子对,根据价层电子对互斥理论可知硫原子的杂化方式为sp3,
故答案为:sp3;
③异硫氰酸分子间含有氢键,异硫氰酸的沸点比硫氰酸沸点高,
故答案为:异硫氰酸分子间含有氢键;
(3) [Cu(NH3)4](OH)2铜离子提供空轨道,氮原子提供孤电子对,铜离子和氨气分子之间形成配位键,氨气分子中氮和氢原子之间以共价键结合,内界离子和外界离子氢氧根离子之间以离子键结合,所以含有的化学键离子键、共价键、配位键,4molNH3总共含有σ键的物质的量为12mol,1mol该配合物中含有4mol配位键,外界的氢氧根离子中也有2molσ键,所以该1mol物质中含有的键的物质的量为18mol,即18NA个键。
故答案为:离子键、共价键、配位键;18NA;
(4)该晶胞中含有氟离子的个数为6×![]() +8×
+8×![]() =4,含有钙离子的个数为8,故该晶胞的质量为
=4,含有钙离子的个数为8,故该晶胞的质量为![]() ,由晶胞的密度可以求出晶胞的体积=
,由晶胞的密度可以求出晶胞的体积=![]() =
= =
=![]() cm3,故晶胞的边长为
cm3,故晶胞的边长为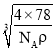 cm。则氟离子和钙离子之间的最小距离就是该晶胞体对角线的
cm。则氟离子和钙离子之间的最小距离就是该晶胞体对角线的![]() ,因此
,因此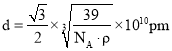 ,
,
故答案为: 。
。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.CO(g)+3H2(g)=CH4(g)+H2O(g)在一定条件下能自发进行,则该反应的ΔH<0
B.向Na2CO3溶液中加入少量CaCl2固体,溶液的pH增大
C.常温下,向0.1mol·L-1的CH3COONH4溶液中加入少量水,![]() 增大
增大
D.氯碱工业中,常温下每生成3.36 L Cl2时,转移电子数为0.3×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。
![]()
(1)写出A、B、C三元素的元素符号_____、_____、_____。
(2)C在元素周期表中的位置是_____。
(3)B的原子结构示意图为_____,C的氢化物与B的氢化物的稳定性强弱顺序为_____(填化学式)。
(4)比较A、C的原子半径:A_____C,写出A的气态氢化物与A的最高价氧化物对应水化物反应的化学方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,反应CCl4(g)+H2(g)![]() CHCl3(g)+HCl(g) ,可使CCl4(沸点77 ℃)转化为重要的化工原料CHCl3(沸点61.2 ℃),可减少其对臭氧层的破坏。(已知:该反应的副反应会生成CH2Cl2、CH3Cl和CH4等)
CHCl3(g)+HCl(g) ,可使CCl4(沸点77 ℃)转化为重要的化工原料CHCl3(沸点61.2 ℃),可减少其对臭氧层的破坏。(已知:该反应的副反应会生成CH2Cl2、CH3Cl和CH4等)
(1)CH4与Cl2反应时,每生成1molCCl4(g)或1molCHCl3(g)的焓变分别是△H1和△H2;H2在Cl2中燃烧,每生成1molHCl(g)产生的焓变为△H3,则:CCl4(g)+H2(g)![]() CHCl3(g)+HCl(g)的△H=_____(用含有△H1、△H2和△H3的算式表示)
CHCl3(g)+HCl(g)的△H=_____(用含有△H1、△H2和△H3的算式表示)
(2)在密闭容器中,CCl4+H2![]() CHCl3+HCl达到平衡状态后,测得如下数据(假设不考虑副反应)。
CHCl3+HCl达到平衡状态后,测得如下数据(假设不考虑副反应)。
实验序号 | 温度/℃ | 初始CCl4浓度/(mol·L-1) | 初始H2浓度/(mol·L-1) | CCl4的平衡转化率 |
1 | 110 | 0.8 | 1.2 | α1 |
2 | 110 | 1 | 1 | 50% |
3 | 100 | 1 | 1 | α3 |
①实验1中,CCl4的转化率α1_____50%(填“大于”“小于”或“等于”)。
②实验2中,反应进行到10h时达到平衡,在这10h内,H2的平均反应速率为_____mol· L-1·min-1。
③110 ℃时,该反应的化学平衡常数的数值为________。
④实验3中,α3的值________。
A. 等于50% B.大于50% C.小于50% D.依题所给信息无法判断

①图中表示H2起始浓度为2mol·L-1CHCl3的百分含量的变化曲线是____(填字母)。
②依图可知,有利于提高CCl4的消耗百分率和产物中CHCl3的百分含量H2的起始浓度应该为________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氯化铜[CuaClb(OH)cH2O]是一种重要的无机杀虫剂,它可以通过以下步骤制备。步骤1:将铜粉加入稀盐酸中,并持续通空气反应后生成CuCl2。已知Fe3+对该反应有催化作用,其催化原理如图所示
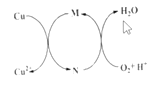
步骤2:在制得的CuCl2溶液中,加入石灰乳充分反应后即可制备碱式氯化铜。下列有关说法正确的是( )
A.a、b、c之间的关系式为:a=b+c
B.图中M、N分别为Fe2+、Fe3+
C.步骤1充分反应后,加入CuO是为了除去Fe3+
D.若制备1molCuCl2,理论上消耗11.2LO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验说法,不正确的是( )
A.碱液不慎溅到手上,先用大量水冲洗,再用饱和硼酸溶液洗,最后用水冲洗
B.![]() 和
和![]() 的混合物经溶解、过滤,洗涤、干燥,可分离出
的混合物经溶解、过滤,洗涤、干燥,可分离出![]()
C.用容量瓶配制溶液,定容时若加水超过刻度线,立即用滴管吸出多余液体
D.火柴头的浸泡液中滴加![]() 溶液,稀
溶液,稀![]() 和
和![]() 溶液,可检验火柴头是否含有氯元素
溶液,可检验火柴头是否含有氯元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上硫酸中的一步重要反应是SO2在400~500。C下的催化氧化2SO2+O2![]() 2SO3,这是一个正反应放热的可逆反应.如果在密闭容器中通入2molSO2和足够多的氧气,按上述条件进行反应,下列有关说法中错误的是
2SO3,这是一个正反应放热的可逆反应.如果在密闭容器中通入2molSO2和足够多的氧气,按上述条件进行反应,下列有关说法中错误的是
A.通过调试反应条件,可以提高该反应的进行程度
B.使用催化剂的目的是加快反应速率,提高生产效率
C.达到平衡时,SO2和SO3的速率相等
D.提高反应温度,可以实现SO2的完全转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用图所示实验装置可以完成中学化学实验中的一些实验。
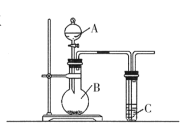
(1)现有稀硝酸、稀盐酸、稀硫酸、碳酸钠粉末、硅酸钠溶液五种试剂。选择三种试剂利用如图装置证明酸性强弱:H2SO4 > H2CO3 > H2SiO3
①仪器B的名称________,A中试剂________,B中试剂________
②C中发生反应的化学方程式:________________________________
(2)利用如图装置实验,证明二氧化硫气体具有漂白性。已知:Na2SO3 + H2SO4=Na2SO4 +SO2↑+H2O。 在装置A中加入 70%的硫酸溶液,B中加入Na2SO3粉末,
①C中应加入________溶液(填“品红”或“石蕊”)。打开分液漏斗活塞,一段时间后观察到C中现象是________________________________,反应完全后,将C试管加热一 段时间发生的现象是________________________
②如果仅用如图装置进行此实验,可能造成环境污染,此污染属于________(选填“白色污染”或“酸雨污染"),因此应该在C装置后加一个盛有________溶液的洗气瓶。
③将二氧化硫气体通入FeCl3溶液中反应一.段时间后,滴加KSCN溶液,溶液未变红色,请写出所发生反应的离子方程式:________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为实现随处可上网,中国发射了“中星16号”卫星。NH4ClO4是火箭的固体燃料,发生反应为2NH4ClO4 ![]() N2↑+Cl2↑+2O2↑+4H2O,NA代表阿伏加德罗常数,下列说法正确的是
N2↑+Cl2↑+2O2↑+4H2O,NA代表阿伏加德罗常数,下列说法正确的是
A. 1mol NH4ClO4溶于水含NH4+和ClO4-离子数均为NA
B. 反应中还原产物分子数与氧化产物分子总数之比为1:3
C. 产生6.4g O2反应转移的电子总数为0.8NA
D. 0.5mol NH4ClO4分解产生的气体体积为44.8L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com