
| A | B | C | D | |
| 方案 | 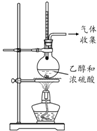 |  |  |  |
| 目的 | 利用乙醇的消去反应制取乙烯 | 蒸发NH4Cl饱和溶液制备NH4Cl晶体 | 制取少量纯净的CO2气体 | 比较乙醇中羟基氢原子和水分子中氢原子的活泼性 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.乙醇和浓硫酸混合制取乙烯需要加热170℃,温度计测量混合溶液温度;
B.氯化铵受热易分解生成氨气和氯化氢;
C.纯碱是粉末状固体,不能用简易启普发生器;
D.钠和乙醇、水都能反应生成氢气,根据反应剧烈程度确定羟基中H原子的活泼性.
解答 解:A.乙醇和浓硫酸混合制取乙烯需要加热170℃,温度计测量混合溶液温,所以温度计水银球应该位于混合溶液中,故A错误;
B.氯化铵受热易分解生成氨气和氯化氢,所以得不到氯化铵晶体,故B错误;
C.纯碱是粉末状固体,不能用简易启普发生器,应该用稀盐酸和石灰石制取二氧化碳,故C错误;
D.钠和乙醇、水都能反应生成氢气,与钠反应的剧烈程度取决于羟基中H原子的活泼性,所以能实现实验目的,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及物质制备、氢原子活泼性比较、仪器的使用等知识点,明确实验原理、物质性质差异性、仪器的用途等是解本题关键,侧重考查学生观察分析判断能力,注意A中温度计的位置,为易错点.


 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:实验题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA |
| 2 | ① | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盛装在敞口玻璃容器中的碘化钾溶液,在空气中久置后,可能会显黄色 | |
| B. | 次氯酸不稳定,见光即分解,可与强碱发生中和反应,则证明次氯酸为弱酸 | |
| C. | 铜粉在氯气中燃烧生成棕色的烟 | |
| D. | 氯水久置后溶液的酸性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CHO | B. | CH3CH2COOH | C. | CH3COCH3 | D. | CH3CH2OCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业通过分馏液态空气制备液氧 | |
| B. | 液氧不可燃,铁路旅客可以随身携带 | |
| C. | 液氧与液氢搭配做火箭推进剂的优点之一是清洁环保 | |
| D. | 沥青若长时间浸入液氧可能会发生爆炸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某城市实时空气质量检测报告中标明空气中包含多种气体污染物,如CO、氮氧化物(NOx)、SO2等.
某城市实时空气质量检测报告中标明空气中包含多种气体污染物,如CO、氮氧化物(NOx)、SO2等. | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.10 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
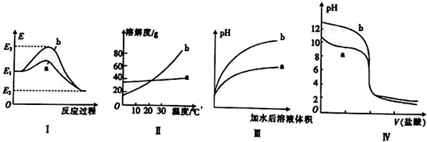
| A. | 图Ⅰ表法某放热反应过程中的能量变化,则曲线a可表示加入催化剂的反应 | |
| B. | 图Ⅱ表示两种盐的溶解度曲线,在较高温度下制得浓溶液再冷却结晶,过滤、洗涤、干燥可得纯净的固体a | |
| C. | 图Ⅲ表示相同pH的盐酸和醋酸分别用水稀释,则曲线a为醋酸 | |
| D. | 图Ⅳ表示相同物质的量浓度的NaOH溶液和氨水分别用盐酸滴定的曲线,则曲线a表示氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
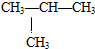 ) ⑤乙醇(C2H5OH)与甲醚(CH3-O-CH3)⑥
) ⑤乙醇(C2H5OH)与甲醚(CH3-O-CH3)⑥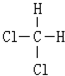 和
和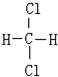
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅为酸性氧化物,可用于制做计算机芯片 | |
| B. | 铜的金属活泼性比铁差,可在海轮外壳上装若干铜块以减缓其腐蚀 | |
| C. | Zn具有还原性和导电性,可用作锌锰干电池的负极材料 | |
| D. | 浓硫酸具有脱水性,可用于干燥NH3、SO2等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com