
【题目】硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二部电离并不完全,其电离情况为:H2SO4=H++HSO4-,HSO4-![]() H++SO42-。请回答下列有关问题:
H++SO42-。请回答下列有关问题:
(1)Na2SO4溶液呈______(填“弱酸性”、“中性”或“弱碱性”),其理由_________________________(用离子反应方程式表示)。
(2)写出H2SO4溶液与BaCl2溶液离子反应方程式______________________________________;
(3)在0.1mol·L-1的Na2SO4溶液中,下列粒子浓度关系式正确的是______。(填字母代号)
A.c(SO42-)+c(HSO4-)=0.1mol·L-1
B.c(OH-)=c(H+)+c(HSO4-)
C.c(Na+)+c(H+)=c(OH-)+c(HSO4-)+c(SO42-)
D.c(Na+)=2c(SO42-)+2c(HSO4-)
(4)若25℃时,0.10mol·L-1的NaHSO4溶液的c(SO42-)=0.029mol·L-1,则0.1mol·L-1的H2SO4溶液中c(SO42-)______0.029mol·L-1(填“>”“=”或“<”),其理由是__________________________________。
(5)若25℃时,0.10mol·L-1的H2SO4溶液的pH=-lg0.11,则0.1mol·L-1的H2SO4溶液中c(SO42-)______mol·L-1。
【答案】弱碱性 SO42-+H2O ![]() HSO4-+OH- HSO4-+Ba2+=BaSO4↓+H+ ABD < H2SO4电离出的H+会抑制HSO4-的电离 0.01
HSO4-+OH- HSO4-+Ba2+=BaSO4↓+H+ ABD < H2SO4电离出的H+会抑制HSO4-的电离 0.01
【解析】
(1)由于硫酸的第二步电离不完全,导致溶液中存在SO42-+H2O ![]() HSO4-+OH-这一水解平衡,导致Na2SO4溶液呈弱碱性;
HSO4-+OH-这一水解平衡,导致Na2SO4溶液呈弱碱性;
(2)根据题目所给信息,硫酸氢根离子不完全电离,故方程式应写为HSO4-+Ba2+=BaSO4↓+H+;
(3)A. 根据物料守恒,可得出c(SO42-)+c(HSO4-)=0.1mol·L-1,A 正确;
B. 根据质子守恒,可得出c(OH-)=c(H+)+c(HSO4-),B正确;
C. 根据电荷守恒,可得出c(Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-),C错误;
D. 根据物料守恒,可得出c(Na+)=2c(SO42-)+2c(HSO4-),D正确;
故答案选ABD;
(4)由于H2SO4电离出的H+会抑制HSO4-的电离,故0.1mol·L-1的H2SO4溶液中c(SO42-)<0.029mol·L-1;
(5)0.10mol·L-1的H2SO4溶液的pH=-lg0.11,可知该溶液中c(H+)=0.11mol/L,第一步电离出的c(H+)=0.1mol/L,则HSO4-电离出的氢离子的浓度为0.11mol/L-0.1mol/L=0.01mol/L,故溶液中硫酸根离子的浓度为0.01mol/L。


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
【题目】下列对电子排布式或电子排布图书写的评价正确的是( )
选项 | 电子排布式或电子排布图 | 评价 |
A. | O原子的电子排布图: | 错误;违反泡利不相容原理 |
B. | N原子的电子排布图: | 错误;违反洪特规则 |
C. | Ca原子的电子排布式:1s22s22p63s23p63d2 | 错误;违反能量最低原理 |
D. | Br-的电子排布式:[Ar]3d104s24p6 | 错误;违反能量最低原理 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写出下列化学方程式或离子方程式:
(1)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为___。
(2)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:___。
(3)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42-,常用作脱氯剂,该反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 常温下,向20 mL 0.01mol/L CH3COOH溶液中逐滴加入0.01mol/L 的NaOH溶液,溶液中水所电离出的c(H+)随加入NaOH溶液的体积变化示意图如图所示,下列说法不正确的是
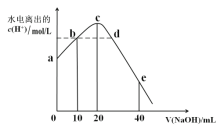
A.从a到c,醋酸的电离始终受到促进
B.a、d对应的纵坐标数值分别是:>10-12、>10-7
C.b点:2c(Na+)=c(CH3COO-)+c(CH3COOH)
D.从b→c的过程中,既存在着pH=7的点,也存在着溶液中水所电离出的c(H+)=10-7的点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置进行实验,甲、乙两池中均为1 mol·L-1的AgNO3溶液,A、B均为Ag电极。实验开始时先闭合K1,断开K2。一段时间后,断开K1,闭合K2,形成浓差电池,电流表指针偏转(Ag+浓度越大氧化性越强)。下列说法不正确的是( )

A. 闭合K1,断开K2后,A电极增重
B. 闭合K1,断开K2后,乙池溶液浓度上升
C. 断开K1,闭合K2后,A电极发生氧化反应
D. 断开K1,闭合K2后,NO![]() 向B电极移动
向B电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是
A.![]() 溶液加水稀释后,溶液中
溶液加水稀释后,溶液中![]()
![]() 的值减小
的值减小
B.中和滴定时,滴定管用所盛装的反应液润洗![]() 次
次
C.浓度均为![]() 的下列溶液,pH由大到小的排列顺序为:
的下列溶液,pH由大到小的排列顺序为:![]()
D.为确定HA是强酸还是弱酸,常温下可测![]() 溶液的pH:若
溶液的pH:若![]() ,则HA是弱酸;若
,则HA是弱酸;若![]() ,则HA是强酸
,则HA是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用已知浓度的盐酸测定未知浓度的NaOH溶液的物质的量浓度,进行酸碱中和滴定时,无论是酸往碱中滴还是碱往酸中滴,下列操作都会使测定结果偏低的是(锥形瓶中溶液用滴定管量取)
A.酸式滴定管未用标准盐酸润洗
B.滴定过程中不慎有液体溅出
C.滴定前仰视读数,滴定后读数正确
D.碱式滴定管未用待测液润洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 铅蓄电池充电时,阳极质量增大
B. 0.1mol ·L-lCH3COONa溶液加热后,溶液的pH减小
C. 标准状况下,11.2L苯中含有的碳原子数为3×6.02×1023
D. 室温下,稀释0.1mol·L-1氨水,c(H+)·c(NH3·H2O)的值减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L的密闭容器中充入2 molX(g)和1 mol Y(g),发生反应2X(g) +Y(g) ![]() 3Z(g) △H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示,下列推断正确的是
3Z(g) △H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示,下列推断正确的是

A.升高温度.平衡常数增大
B.W点Y的正反应速率等于M点Y的正反应速率
C.Q点时,Y的转化率最大
D.平衡时充入3molZ,达到新平衡时Z的体积分数比原平衡时大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com