
【题目】25 ℃时,向0.10 mol·L-1 H2S溶液中通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)的关系如图(忽略溶液体积的变化、H2S的挥发)。已知H2S的Ka1=1.3×10-7,Ka2=7.1×10-15,CdS的Ksp=3.6×10-29,一般认为溶液中离子浓度不大于1.0×10-5 mol·L-1时即沉淀完全。下列说法正确的是
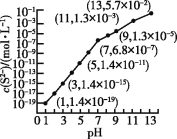
A. pH=13时,溶液中的溶质为Na2S
B. pH=5时,向H2S溶液中通入了少量的HCl
C. pH=7时,溶液中c(H2S)≈0.043 mol·L-1
D. pH=1时,c(S2-)太小,故不能处理含Cd2+的污水
【答案】C
【解析】
A、根据题图的信息,pH=13时,c(S2-)=5.7×10-2 mol·L-1,若溶质为Na2S,则根据S元素守恒,c(S2-)应接近0.10 mol·L-1,A错误;
B、0.10 mol·L-1 H2S溶液中,电离平衡常数的公式Ka1=![]() =1.3×10-7,由于溶液中c(HS-)与c(H+)近似相等,则c(H+)≈10-4 mol·L-1,即0.10 mol·L-1 H2S溶液的pH约为4;若向H2S溶液中通入了少量的HCl,c(H+)会增大,pH<4,B错误;
=1.3×10-7,由于溶液中c(HS-)与c(H+)近似相等,则c(H+)≈10-4 mol·L-1,即0.10 mol·L-1 H2S溶液的pH约为4;若向H2S溶液中通入了少量的HCl,c(H+)会增大,pH<4,B错误;
C、根据溶液中的S元素守恒,可以得出c(H2S)+c(HS-)+c(S2-)=0.10 mol·L-1,pH=7时,c(S2-)=6.8×10-7 mol·L-1,则c(H2S)+c(HS-)+6.8×10-7 mol·L-1=0.10 mol·L-1①,又由Ka1=![]() =1.3×10-7,可以推出
=1.3×10-7,可以推出![]() ②,将②式代入①式,可算出c(H2S)≈0.043 mol·L-1,C正确;
②,将②式代入①式,可算出c(H2S)≈0.043 mol·L-1,C正确;
D、pH=1时,c(S2-)=1.4×10-19 mol·L-1,根据Ksp=c(Cd2+)·c(S2-)=3.6×10-29,算出c(Cd2+)=2.57×10-10 mol·L-1<1.0×10-5 mol·L-1,故可以处理含Cd2+的污水,D错误。
答案选C。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】在高压下氮气会发生聚合得到高聚氮,这种高聚氮的N—N键的键能为160kJ·mol-1(N2的键能为942kJ·mol-1),晶体片段结构如右图所示。又发现利用N2可制取出N5、N3。含N5+离子的化合物及N60、N5极不稳定。则下列说法错误的是( )
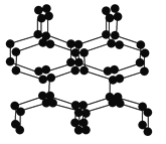
A. 按键型分类,该晶体中含有非极性共价键
B. 含N5+离子的化合物中既有离子键又有共价键
C. 高聚氮与N2、N3、N5、N5+、N60互为同素异形体
D. 这种固体的可能潜在应用是烈性炸药或高能材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气,所需实验装置如图所示

(1)写出装置中发生反应的程式________
(2)连接上述仪器,仪器的正确连接顺序是 a→________
(3)NaOH 溶液的作用是(用化学方程式表示)________
(4)将干燥的 Cl2 依次通过干燥的有色布条和湿润的有色布条,可观察到的现象是________,得出的结论是________
(5)实验结束后,取少量 E 装置中的溶液于烧杯中,加入足量浓盐酸后会产生一种黄绿色气体,写出生成该气体的离子方程式________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由一氧化碳、甲烷和乙烷组成的混合气体8.96L(标准状况),在足量氧气中充分燃烧后,生成气体先通过足量浓硫酸.再通过足量氢氧化钠溶液,测知氢氧化钠溶液增重26.4g,则原混合气体中乙烷的物质的量为
A. 0.1molB. 大于或等于0.2mo1,小于0.3molC. 等于0.2 molD. 大于0.1mol小于0.3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】托盘天平、容量瓶、量筒是常见的中学化学计量仪器,熟知这些仪器的使用是定量研究化学的基础。
(1)其中标示出使用温度的仪器是________________。
(2)下列操作中,容量瓶所不具备的功能有________________ (填序号)。
A.配制一定体积准确浓度的标准溶液 B.贮存溶液
C.测量容量瓶规格以下的任意体积的溶液 D.准确稀释某一浓度的溶液
E.量取一定体积的液体 F.用来加热溶解固体溶质
(3)如图是某些仪器的刻度部分示意图,图中各仪器虚线为所示读数。其中为量筒的是________________ (填编号,),读数为_____mL。

(4)实验室用98%的浓硫酸配制(浓硫酸的密1.84g/mL)450mL 0.1 mol·L-1的硫酸。回答下列问题
① 配制中应选用的玻璃仪器有_________________,应量取________mL 98%的浓硫酸。
② 量筒在使用前已洗干净但不干燥,对结果是否造成影响________(填“是”或“否”),某同学认为将量筒内的浓硫酸倒出之后,应将量筒洗涤—下并将洗涤液倒入烧杯中,最后转移到容量瓶中,你认为他的做法______(填“对”或“错”)。
③对浓硫酸稀释过程中遇到下列情况,使所配制的硫酸浓度大于 0.1mol/L有 ______(填序号)
A.未经冷却趁热将溶液注入容量瓶中
B.摇匀后发现液面低于刻度线,再加水至刻度线
C.容量瓶中原有少量蒸馏水
D.定容时俯视观察液面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列关于0.2 mol·L1 K2SO4溶液的说法正确的是
A. 1 L溶液中K+浓度是0.4 mol·L1
B. 500 mL溶液中含有0.1NA个K+
C. 1 L溶液中所含K+、![]() 总数为0.3NA
总数为0.3NA
D. 2 L溶液中![]() 浓度是0.4 mol·L1
浓度是0.4 mol·L1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数。下列说法中正确的是( )
A. 1molCl2与1molCH4恰好完全反应,则转移的电子总数为2NA
B. 15g甲基(—CH3)所含电子数为10NA
C. 2.8g ![]() 中含有的碳原子数为0.2n NA
中含有的碳原子数为0.2n NA
D. 标准状况下,2.24LCHCl3含有的分子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是( )
A. 小苏打溶液与少量澄清石灰水混合:Ca2++OH-+HCO3-===CaCO3↓+H2O
B. AlCl3溶液中加入足量的氨水:Al3++4OH-===AlO2-+2H2O
C. 将氯气通入水中:Cl2+H2O===Cl-+ClO-+2H+
D. 向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-===3Fe3++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700℃时反应制造出纳米级金刚石粉末和另一种化合物。该成果发表在世界权威的《科学》杂志上,被科学家们高度评价为“稻草变黄金”。下列有关说法中,你认为错误的是( )
A. Na的还原性强于金刚石B. 另一种化合物是NaCl
C. 纳米级金刚石粉末可以透过半透膜D. 这个反应是置换反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com