
【题目】实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气,所需实验装置如图所示

(1)写出装置中发生反应的程式________
(2)连接上述仪器,仪器的正确连接顺序是 a→________
(3)NaOH 溶液的作用是(用化学方程式表示)________
(4)将干燥的 Cl2 依次通过干燥的有色布条和湿润的有色布条,可观察到的现象是________,得出的结论是________
(5)实验结束后,取少量 E 装置中的溶液于烧杯中,加入足量浓盐酸后会产生一种黄绿色气体,写出生成该气体的离子方程式________
【答案】MnO2+4HCl ![]() MnCl2+Cl2↑+2H2O d→e→b→c→f→g→h Cl2+2NaOH=NaCl+ NaClO+H2O Cl2能使湿润的有色布条褪色 干燥的氯气没有漂白性,潮湿的氯气中含有次氯酸,具有漂白性 2H++Cl -+ ClO- = H2O + Cl2↑
MnCl2+Cl2↑+2H2O d→e→b→c→f→g→h Cl2+2NaOH=NaCl+ NaClO+H2O Cl2能使湿润的有色布条褪色 干燥的氯气没有漂白性,潮湿的氯气中含有次氯酸,具有漂白性 2H++Cl -+ ClO- = H2O + Cl2↑
【解析】
(1)二氧化锰与浓盐酸反应,生成氯化锰、氯气和水;
(2)浓盐酸和二氧化锰反应生成的氯气中含有HCl杂质,先通过饱和食盐水,除去HCl后,通入浓硫酸中干燥,收集气体,多余的气体用氢氧化钠溶液吸收,由此连接装置;
(3)实验中多余的氯气用氢氧化钠溶液吸收;
(4)干燥的氯气没有漂白性,氯气和水结合生成次氯酸,次氯酸具有漂白性;
(5)E装置中的物质为氯化钠、次氯酸钠和水,其中能和浓盐酸反应的是次氯酸钠,次氯酸钠与浓盐酸发生氧化还原反应,生成黄绿色气体氯气。
(1)二氧化锰与浓盐酸反应,生成氯化锰、氯气和水,反应方程式为:MnO2+4HCl ![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)浓盐酸和二氧化锰反应生成的氯气中含有HCl杂质,先通过饱和食盐水,除去HCl后,通入浓硫酸中干燥,收集气体,多余的气体用氢氧化钠溶液吸收,仪器的连接顺序为:a→d→e→b→c→f→g→h
(3)用氢氧化钠溶液吸收多余的氯气,反应为:Cl2+2NaOH=NaCl+ NaClO+H2O;
(4)干燥的氯气没有漂白性,不能使有色布条褪色,氯气和水结合生成盐酸和次氯酸,次氯酸具有漂白性,可使有色布条褪色;
(5)E装置中的物质为氯化钠、次氯酸钠和水,其中能和浓盐酸反应的是次氯酸钠,次氯酸钠与浓盐酸发生氧化还原反应,生成黄绿色气体氯气,反应方程式为:2HCl + NaClO = NaCl + H2O + Cl2↑,离子方程式为:2H++Cl -+ ClO- = H2O + Cl2↑;


科目:高中化学 来源: 题型:
【题目】向Ba(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体体积(V)的关系如下图所示,试回答:
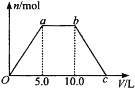
(1)a点之前的反应的离子方程式为________________。
(2)a点到b点之间的反应的离子方程式是________________、________________。
(3)c点二氧化碳体积是________L。
(4)混合稀溶液中Ba(OH)2和NaOH的物质的量之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)Na、Cu、O、Si、S、Cl是常见的六种元素.
(1)Na位于元素周期表第__周期第__族;S的基态原子核外有__个未成对电子;
Si的基态原子核外电子排布式为__.
(2)用“>”或“<”填空:
第一电离能 | 离子半径 | 熔点 | 酸性 |
Si______S | O2-______Na+ | NaCl ______ Si | H2SO4 __________HClO4 |
(3)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取.写出该反应的离子方程式,并标出电子转移的方向和数目___
(二).某元素的原子序数为33,请回答:
(1)该元素原子核外有_______个电子层,______个能级,______个原子轨道。
(2)它的最外层电子排布式为____________,它的电子排布式为________,轨道表示式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氯酸钠等为原料制备亚氯酸钠的工艺流程如下,下列说法错误的是

A. NaClO3在发生器中作氧化剂
B. 吸收塔中1mol H2O2得到2mol电子
C. 吸收塔中温度不宜过高,会导致H2O2的分解
D. 从“母液”中可回收的主要物质是Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识,回答下列问题:
I. 0.5L 1mol·l-1 氢氧化钠溶液中所含溶质的质量为________g,加水将溶液稀释到10L,其物质的量浓度是_________mol·l-1,取稀释后的溶液 10mL,其溶质的物质的量浓度是________mol·L-1.
Ⅱ.标准状况下,比较等物质的量 H2S、NH3、CH4 三种气体,并完成下列填空。
(1)体积之比________
(2)质量之比为________
(3)原子数之比为________
(4)氢原子数之比为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列卤代烃在KOH醇溶液中加热不反应的是( )
①![]() ②
②![]() ③ (CH3)3CCH2Cl ④ CHCl2CHBr2 ⑤
③ (CH3)3CCH2Cl ④ CHCl2CHBr2 ⑤ ![]() ⑥ CH3Cl
⑥ CH3Cl
A. ①③⑥B. ②③⑤C. 全部D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.2L由NaCl、MgCl2、BaCl2组成的混合溶液中,部分离子浓度大小如图所示,对于该溶液成分。下列说法不正确的是( )

A. NaCl的物质的量为0.2mol
B. 溶质MgCl2的质量为9g
C. 该混合液中BaCl2的物质的量为0.1mol
D. 将该混合液加水稀释至体积为1L,稀释后溶液中Ba2+的物质的量浓度为0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,向0.10 mol·L-1 H2S溶液中通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)的关系如图(忽略溶液体积的变化、H2S的挥发)。已知H2S的Ka1=1.3×10-7,Ka2=7.1×10-15,CdS的Ksp=3.6×10-29,一般认为溶液中离子浓度不大于1.0×10-5 mol·L-1时即沉淀完全。下列说法正确的是
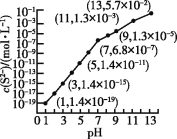
A. pH=13时,溶液中的溶质为Na2S
B. pH=5时,向H2S溶液中通入了少量的HCl
C. pH=7时,溶液中c(H2S)≈0.043 mol·L-1
D. pH=1时,c(S2-)太小,故不能处理含Cd2+的污水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列所示图像中,纵坐标为沉淀物的物质的量,横坐标为某溶液中加入反应物的物质的量,按题给信息将相应图的字母填入下列空格中,并写出所发生反应的离子方程式。

(1)表示向饱和AlCl3溶液中滴加氨水至过量的图像是_____(填字母,下同),离子方程式为:_____________________。
(2)表示向饱和AlCl3溶液中滴加NaOH溶液至过量的图像是_____,离子方程式为:__________________。
(3)表示向饱和石灰水中通入CO2至过量的图像是_____,离子方程式为:_____________。
(4)表示向MgCl2和AlCl3的混合溶液中滴加NaOH溶液至过量的图像是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com