
【题目】根据所学知识,回答下列问题:
I. 0.5L 1mol·l-1 氢氧化钠溶液中所含溶质的质量为________g,加水将溶液稀释到10L,其物质的量浓度是_________mol·l-1,取稀释后的溶液 10mL,其溶质的物质的量浓度是________mol·L-1.
Ⅱ.标准状况下,比较等物质的量 H2S、NH3、CH4 三种气体,并完成下列填空。
(1)体积之比________
(2)质量之比为________
(3)原子数之比为________
(4)氢原子数之比为________
【答案】20 0.05 0.05 1:1:1 34:17:16 3:4:5 2:3:4
【解析】
I. m=cVM=1mol·l-1×0.5L×40g/mol=20g;
c2=![]() =
=![]() =0.05 mol·l-1;
=0.05 mol·l-1;
从10L的溶液中取出其中的10ml,溶液的溶度不发生变化,依然是0.05 mol·l-1;
Ⅱ.(1)根据阿伏伽德罗定律有体积之比等于物质的量之比,三种气体的物质的量相同,则体积之比为1:1:1;
(2)由m=nM,可知质量之比为摩尔质量之比,则三种气体的质量之比=34:17:16;
(3)H2S由3个原子构成,NH3由4个原子构成,CH4 由5个原子构成,物质的量相同的三种气体原子数之比为3:4:5;
(4)H2S中含有2个氢原子, NH3中含有3个氢原子,CH4中含有4个氢原子,则三种气体的氢原子数之比为2:3:4。


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】下列事实或操作不符合平衡移动原理的是( )
A. 开启啤酒有泡沫逸出
B. 向FeCl3溶液中加KSCN,有![]() Fe(SCN)3(血红色)+3KCl反应,平衡后向体系中加入KCl固体,使体系红色变浅
Fe(SCN)3(血红色)+3KCl反应,平衡后向体系中加入KCl固体,使体系红色变浅
C. 装有![]() 的烧瓶置于热水中颜色加深
的烧瓶置于热水中颜色加深
D. 实验室用排饱和食盐水的方法收集氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,从A处通入新制备的Cl2,关闭B阀时,C处的红色布条看不到明显现象;当打开B阀后,C处红色布条逐渐褪色。D瓶中装的是( )

①浓硫酸 ②NaOH溶液 ③H2O ④饱和NaCl溶液
A. ①③ B. ②④ C. ①② D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D, E、F、G、H是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如下表:
元素 | 相关信息 |
A | 原子核外有6种不同运动状态的电子 |
C | 基态原子中s电子总数与p电子总数相等 |
D | 原子半径在同周期元素中最大 |
E | 基态原子最外层电子排布式为3s23p1 |
F | 基态原子的最外层p轨道有两个电子的自旋方向与其他电子的自旋方向相反 |
G | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
H | 是我国使用最早的合金中的最主要元素 |
请用化学用语填空:
(1)A元素位于元素周期表第_______周期_______族;B元素和C元素的第一电离能比较,较大的是________,C元素和F元素的电负性比较,较小的是________。
(2)B元素与宇宙中含量最丰富的元素形成的最简单化合物的分子模型为________,B元素所形成的单质分子![]() 键与π键数目之比为________。
键与π键数目之比为________。
(3)G元素的低价阳离子的离子结构示意图是________,F元素原子的价电子的轨道表示式是________,H元素的基态原子核外电子排布式的________。
(4)G的高价阳离子的溶液与H单质反应的离子方程式为_________________;与E元素成对角线关系的某元素的最高价氧化物的水化物具有两性,写出该两性物质与D元素的最高价氧化物的水化物反应的离子方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组的同学在网上查询资料时得知,干燥的CO2与Na2O2不能反应,只有在水蒸气存在下二者才能发生反应。他们设计了如图所示实验装置,用于验证上述结论。
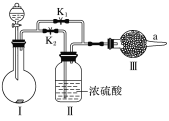
(1)装置Ⅰ中的试剂的最佳组合是________(填字母)。
a.稀盐酸 b.稀硫酸
c.小苏打 d.石灰石
(2)实验时,甲同学认为关闭K1、打开K2,通过观察________判断此时Ⅲ中是否发生了化学反应。
(3)乙同学认为可以分别按“先关闭K1、打开K2,再关闭K2、打开K1”的方式进行操作,并在a处收集所得气体,然后用带火星的木条检验收集到的气体,但他发现两种情况下木条均没有复燃。
①丙同学经过观察分析,建议在Ⅲ后安装一个盛有碱石灰的干燥管,目的是________________
②丁同学认为即使采纳丙同学的建议且最终观察到木条复燃,也不能证明CO2参与了反应,原因是________________________
(4)为进一步达到实验目的,应补充的实验操作是:取最终反应后Ⅲ中所得固体,____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气,所需实验装置如图所示

(1)写出装置中发生反应的程式________
(2)连接上述仪器,仪器的正确连接顺序是 a→________
(3)NaOH 溶液的作用是(用化学方程式表示)________
(4)将干燥的 Cl2 依次通过干燥的有色布条和湿润的有色布条,可观察到的现象是________,得出的结论是________
(5)实验结束后,取少量 E 装置中的溶液于烧杯中,加入足量浓盐酸后会产生一种黄绿色气体,写出生成该气体的离子方程式________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,Na、NaOH、NaHCO3分别与等物质的量的该物质恰好反应时,Na、NaOH、NaHCO3的物质的量之比为( )
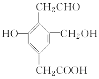
A. 3∶3∶2B. 3∶2∶1
C. 1∶1∶1D. 3∶2∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】托盘天平、容量瓶、量筒是常见的中学化学计量仪器,熟知这些仪器的使用是定量研究化学的基础。
(1)其中标示出使用温度的仪器是________________。
(2)下列操作中,容量瓶所不具备的功能有________________ (填序号)。
A.配制一定体积准确浓度的标准溶液 B.贮存溶液
C.测量容量瓶规格以下的任意体积的溶液 D.准确稀释某一浓度的溶液
E.量取一定体积的液体 F.用来加热溶解固体溶质
(3)如图是某些仪器的刻度部分示意图,图中各仪器虚线为所示读数。其中为量筒的是________________ (填编号,),读数为_____mL。

(4)实验室用98%的浓硫酸配制(浓硫酸的密1.84g/mL)450mL 0.1 mol·L-1的硫酸。回答下列问题
① 配制中应选用的玻璃仪器有_________________,应量取________mL 98%的浓硫酸。
② 量筒在使用前已洗干净但不干燥,对结果是否造成影响________(填“是”或“否”),某同学认为将量筒内的浓硫酸倒出之后,应将量筒洗涤—下并将洗涤液倒入烧杯中,最后转移到容量瓶中,你认为他的做法______(填“对”或“错”)。
③对浓硫酸稀释过程中遇到下列情况,使所配制的硫酸浓度大于 0.1mol/L有 ______(填序号)
A.未经冷却趁热将溶液注入容量瓶中
B.摇匀后发现液面低于刻度线,再加水至刻度线
C.容量瓶中原有少量蒸馏水
D.定容时俯视观察液面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Mg2+、NH4+、Al3+混合溶液中加入Na2O2的量与生成沉淀和气体的量(纵坐标)的关系如图所示,则溶液中Mg2+、NH4+、Al3+三种离子的物质的量之比为( )
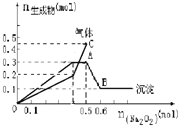
A. 1∶1∶2B. 2∶2∶1
C. 1∶2∶2D. 9∶2∶4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com