
【题目】水的电离常数如图两条曲线所示,曲线中的点都符合![]() 常数,下列说法错误的是
常数,下列说法错误的是![]()
![]()

A.图中温度![]()
B.图中五点![]() 间的关系:
间的关系:![]()
C.曲线a、b均代表纯水的电离情况
D.若处在B点时,将![]() 的硫酸溶液与
的硫酸溶液与![]() 的KOH溶液等体积混合后,溶液显碱性
的KOH溶液等体积混合后,溶液显碱性
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列字母分别代表一种元素.

(1)常温下,其单质呈液态的元素是____(填字母代号),它与e形成的化合物电子式为:_____(用元素符号表示)
b元素形成的单质所属品体类型可能是____(填序号)
①分子晶体 ②原子晶体 ③金属晶体 ④离子晶体 ⑤过渡型晶体
(2)元素c、d、g的氢化物的沸点由高到低的顺序为______(用化学式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】零排放、太阳能、绿色光源等高科技点亮2010上海世博。
(1)世博园区外围设置生态化停车场,有害尾气被纳米光触媒涂料分解为无毒物质,汽车尾气中的下列物质属于由极性键形成的非极性分子的是____。
a.CO b.NO c.NO2 d.CO2
(2)“一轴四馆”中安装了高亮度节能的陶瓷金卤灯,金卤灯中填充物通常包含NA,81Tl、49In、SC,I等元素的单质或化合物.有关说法正确的是_____。
a.第ⅢA元素铊和铟,第一电离能Tl小于In
b.元素Sc位于周期表s区
c.钠的熔点低,是因为金属键较弱
d.I2溶于KI溶液,可产生I3-,由价层互斥理论可推知I3-呈直线形
(3)世博锗广泛采用了冰蓄冷空调.冰蓄冷空调采用液态化合物乙二酵(HOCH2CH2OH)介质,乙二醇沸点高,是由于_____。
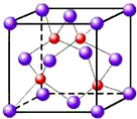
(4)上海城区大规模集中使用“21世纪绿色光源”LED半导体照明,LED晶片采厢砷化镓(GaAs)等材料组成。其中Ga原子在基态时,核外电子排布式为:_____。GaAs的晶胞结构如图,晶胞中含砷原子数为_____。
(5)“东方之冠”(中国馆)表面装有7000多块红色铝板,红色铝板为新型氟碳喷涂型材,一种氟碳涂层聚脂(FEP),它的单体为CF3﹣CF=CF2,该分子中碳原子的杂化方式有:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应aA(g)+bB(g)![]() cC(g)+dD(g),反应过程中,当其他条件不变时,C的百分含量与温度(T)和压强(p)的关系如图。下列叙述不正确的是
cC(g)+dD(g),反应过程中,当其他条件不变时,C的百分含量与温度(T)和压强(p)的关系如图。下列叙述不正确的是
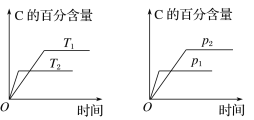
A.达平衡后,若升温,平衡左移
B.达平衡后,加入催化剂,则C的百分含量不变
C.化学方程式中a+b>c+d
D.达平衡后,减小A的量有利于平衡向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种常见的单质,B、C为中学化学常见的化合物,A、B、C均含有元素X。它们有如下的转化关系(部分产物及反应条件已略去),下列判断正确的是
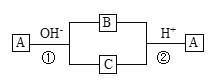
A.X元素可能为Al
B.X元素不一定为非金属元素
C.反应①和②互为可逆反应
D.反应①和②一定为氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对氧化还原反应:11P+15CuSO4+24H2O→5Cu3P+6H3PO4+15H2SO4,下列说法正确的是
A.5/11的磷被氧化
B.3mol CuSO4可氧化11/5mol P
C.每摩尔起氧化作用的磷能氧化磷生成磷酸的物质的量为0.6mol
D.当1mol P参加反应时,转移电子的物质的量为3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、乙二酸俗名草酸,为了测定草酸晶体(H2C2O4·xH2O)中的x值。通过查阅资料,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,学习小组的同学设计了滴定的方法测定x值。
①称取1.260 g纯草酸晶体,将其制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4。
③用浓度为0.1000 mol·L-1的酸性KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL。
(1)滴定时,将酸性KMnO4标准液装在____________滴定管(填“酸式”或“碱式”)。
(2)本实验滴定达到终点的标志是__________________________。
(3)通过上述数据,求得x=________。
讨论:
①若滴定终点时俯视滴定管刻度,则由此测得的x值会________(填“偏大”“偏小”或“不变”,下同)。
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x值会________。
II、(1)25℃时将amolL-1的氨水与0.01molL-1的盐酸等体积混合所得溶液中c(NH4+)=c(Cl-),用含a的代数式表示NH3H2O的电离平衡常数Kb=______
(2)25℃时,H2SO3 ![]() HSO3-+ H+的电离常数Ka = 1×10-2molL-1,则该温度下pH=3、
HSO3-+ H+的电离常数Ka = 1×10-2molL-1,则该温度下pH=3、
c(HSO3-)= 0.1molL-1的NaHSO3 溶液中c(H2SO3)=______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要意义
(1)工业合成氨工业常用的催化剂是____________,氨分子的电子式是__________
(2)图是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式_______。(热量Q的数值用含字母a、b的代数式表示)
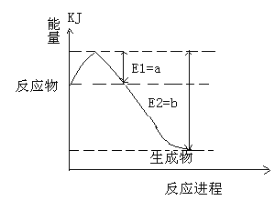
(3)下列有关该反应的说法正确的是_____(填序号)
A.保持容器的体积不变,当混合气体的密度不变时,说明反应已经达到平衡状态。
B.达到平衡时若升高温度,混合气体中氮元素的质量分数将变大。
C.达到平衡时若减少容器的体积,正反应速率将大于逆反应速率。
D.达到平衡后,N2的转化率和H2的转化率一定相等。
(4)在催化剂存在下,NH3可用来消除NO的污染,生成两种对环境无害的物质。写出反应的化学方程式:_____________________;该反应中氧化产物与还原产物的物质的量之比是___________
(5)把NH3通入盐酸溶液中,所得溶液的pH=7, 此时溶液中离子浓度关系是__________ ; ______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列装置,回答下列问题。
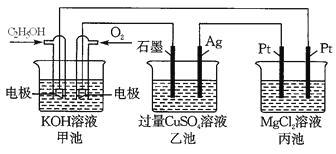
(1) 甲装置中通入乙醇的电极反应式为_______________________________________。
(2) 用上图装置电解200 mL 1mol/L CuSO4溶液,石墨电极上的电极反应式是________,在Ag电极附近观察到的现象是_____________________________。
(3) 电解一段时间,当甲池消耗了112 mLO2(标况下),此时乙装置中溶液的pH为_______(忽略电解前后体积变化)。若要将该溶液完全恢复到电解前的浓度和pH,需要补充的物质是_____________,其物质的量为___________。
(4) 丙装置中总反应的离子方程式为____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com