
【题目】观察下列装置,回答下列问题。
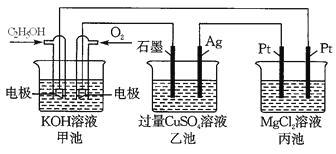
(1) 甲装置中通入乙醇的电极反应式为_______________________________________。
(2) 用上图装置电解200 mL 1mol/L CuSO4溶液,石墨电极上的电极反应式是________,在Ag电极附近观察到的现象是_____________________________。
(3) 电解一段时间,当甲池消耗了112 mLO2(标况下),此时乙装置中溶液的pH为_______(忽略电解前后体积变化)。若要将该溶液完全恢复到电解前的浓度和pH,需要补充的物质是_____________,其物质的量为___________。
(4) 丙装置中总反应的离子方程式为____________________________________________。
【答案】C2H5OH-12e-+16OH-==2CO32-+11H2O 4OH--4e-==H2O+O2↑或 2H2O-4e-==O2↑+4H+ 有红色固体(Cu)析出 1 CuO或CuCO3 0.01mol Mg2++2Cl-+2H2O![]() Mg(OH)2↓+H2↑+Cl2↑。
Mg(OH)2↓+H2↑+Cl2↑。
【解析】
甲池为燃料电池,乙池和丙池都为电解池。甲池中,加入乙醇的电极为负极,通氧气的电极为正极;则乙池中石墨电极为阳极,Ag电极为阴极;丙池中,左边Pt电极为阳极,右边Pt电极为阴极。
(1) 甲装置中加入乙醇的电极为负极,乙醇失电子,生成的产物再与KOH溶液反应,最后生成碳酸盐和水。
(2) 用上图装置电解200 mL 1mol/L CuSO4溶液,石墨电极上发生H2O失电子生成O2和H+的反应,在Ag电极上发生Cu2+得电子生成Cu的反应,由此可确定此电极附近观察到的现象。
(3) 电解一段时间,当甲池消耗了112 mLO2(标况下),利用电荷守恒,可求出乙装置中生成n(H+),从而求出溶液的pH。若要将该溶液完全恢复到电解前的浓度和pH,则需往溶液中加入阴、阳极生成物发生化合反应的产物。
(4) 丙装置中电解MgCl2溶液,可利用电解饱和食盐水的反应进行类推,同时要注意差异性,即生成Mg(OH)2沉淀。
(1)甲装置中加入乙醇的电极为负极,乙醇失电子,生成的产物再与KOH溶液反应,最后生成碳酸盐和水,电极反应式为C2H5OH-12e-+16OH-==2CO32-+11H2O。答案为:C2H5OH-12e-+16OH-==2CO32-+11H2O;
(2) 用上图装置电解200 mL 1mol/L CuSO4溶液,石墨电极(阳极)上发生H2O失电子生成O2和H+的反应,电极反应式为4OH--4e-==H2O+O2↑或 2H2O-4e-==O2↑+4H+;在Ag电极(阴极)上发生反应Cu2++2e-=Cu,此电极附近观察到的现象为有红色固体(Cu)析出。答案为:4OH--4e-==H2O+O2↑或 2H2O-4e-==O2↑+4H+;有红色固体(Cu)析出;
(3)n(O2)=![]() =0.005mol,由O2——4H+,可求出n(H+)=0.005mol×4=0.02mol,c(H+)=
=0.005mol,由O2——4H+,可求出n(H+)=0.005mol×4=0.02mol,c(H+)=![]() =0.1mol/L,pH=1。阳极生成O2(0.005mol),阴极生成Cu(0.01mol),2Cu+O2=2CuO(0.01mol),所以需往电解后的溶液中加入0.01mol CuO或CuCO3,可将该溶液完全恢复到电解前的浓度和pH。答案为:有红色固体(Cu)析出;1;CuO或CuCO3;0.01mol;
=0.1mol/L,pH=1。阳极生成O2(0.005mol),阴极生成Cu(0.01mol),2Cu+O2=2CuO(0.01mol),所以需往电解后的溶液中加入0.01mol CuO或CuCO3,可将该溶液完全恢复到电解前的浓度和pH。答案为:有红色固体(Cu)析出;1;CuO或CuCO3;0.01mol;
(4) 丙装置中电解MgCl2溶液,可利用电解饱和食盐水的反应进行类推,从而得出总反应的离子方程式为Mg2++2Cl-+2H2O![]() Mg(OH)2↓+H2↑+Cl2↑。答案为:Mg2++2Cl-+2H2O
Mg(OH)2↓+H2↑+Cl2↑。答案为:Mg2++2Cl-+2H2O![]() Mg(OH)2↓+H2↑+Cl2↑。
Mg(OH)2↓+H2↑+Cl2↑。


科目:高中化学 来源: 题型:
【题目】水的电离常数如图两条曲线所示,曲线中的点都符合![]() 常数,下列说法错误的是
常数,下列说法错误的是![]()
![]()

A.图中温度![]()
B.图中五点![]() 间的关系:
间的关系:![]()
C.曲线a、b均代表纯水的电离情况
D.若处在B点时,将![]() 的硫酸溶液与
的硫酸溶液与![]() 的KOH溶液等体积混合后,溶液显碱性
的KOH溶液等体积混合后,溶液显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据以下知识解答
![]() +R2-CHO →
+R2-CHO → (R代表烃基,下同。)
(R代表烃基,下同。)
![]() +H2
+H2![]()
![]()
1,4―丁二醇是生产工程塑料PBT(聚对苯二甲酸丁二酯)的重要原料,它可以通过下图两种不同的合成路线制备,请写出相应物质的结构简式
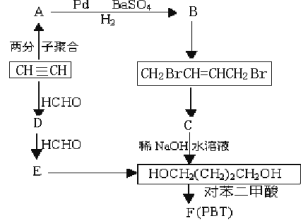
(1)请写出A和D的结构简式:________________________、_____________________。
(2)写出生成CH2BrCH=CHCH2Br的化学反应方程式:______写出生成F (PBT)的化学反应方程式:___。
(3)关于对苯二甲酸的结构,在同一直线上的原子最多有________个。
(4)某学生研究发现由乙炔可制得乙二醇,请你设计出合理的反应流程图。________________
提示:①合成过程中无机试剂任选 ②反应流程图表示方法示例如下:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年11月《Science》杂志报道了王浩天教授团队发明的制取H2O2的绿色方法,原理如图所示(已知:H2O2=H++HO2-,Ka=2.4×10-12)。下列说法错误的是( )
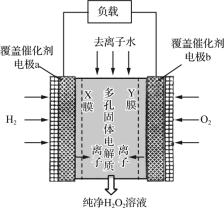
A.X膜为选择性阳离子交换膜
B.催化剂可促进反应中电子的转移
C.每生成1 mol H2O2电极上流过4 mol e-
D.b极上的电极反应为O2+H2O+2e-=HO2-+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“氯化反应”一般指将氯元素引入化合物中的反应,一般包括置换氯化、加成氯化和氧化氯化。已知在制“氯乙烯反应”中, HC≡CH (g)+HCl(g)![]() CH2=CHCl(g)的反应机理如图所示:
CH2=CHCl(g)的反应机理如图所示:

下列说法正确的是
A.碳碳叁键的键能:M1小于CH≡CH
B.由题图可知M2→M3的变化过程是热能转变成化学能的过程
C.该氯乙烯反应的总反应速率取决于M2→M3的反应速率
D.HgCl2是“氯化反应”的催化剂,不会参与反应的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火力发电厂释放出大量氮氧化合物(NOx)、SO2和CO2等气体会造成环境问题。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
CH4(g)+4NO(g)==2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ/mol
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(g)的热化学方程式:_________________。
(2)脱碳。
方法一:在恒容密闭容器中将CO2转化为甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
①下列条件可以判定该反应到达平衡状态的是_________(填字母)。
A.2v正(H2)=v逆(CH3OH) B.容器内气体的密度不变
C.容器内压强不变 D.反应不再释放热量
方法二:让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)![]() 2CO(g) H,测得压强、温度对CO的体积分数[φ(CO)%]的影响如图所示,回答下列问题:
2CO(g) H,测得压强、温度对CO的体积分数[φ(CO)%]的影响如图所示,回答下列问题:
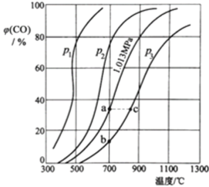
②图中p1、p2、p3的大小关系是_________________,图中a、b、c三点对应的平衡常数Ka、Kb、Kc大小关系是____________。
③900℃、1.013MPa时,1molCO2与足量碳反应达平衡后容器的体积为V L,CO2的转化率为______(保留一位小数),该反应的平衡常数K=_________。
方法三:用NaOH溶液吸收CO2。
④在NaOH溶液中通入一定量的CO2气体,所得溶液中c(HCO32-):c(CO32-)=4:1,此时溶液的pH=_______。(已知:室温下,H2CO3的K1=4×10-7,K2=5×10-11。lg2=0.3)
(3)脱硫。燃煤废气经脱硝、脱碳后,与一定量氨气、空气反应,生成(NH4)2SO4。(NH4)2SO4水溶液呈酸性的原因是_______________(用离子方程式表示);室温时,向(NH4)2SO4溶液中滴入NaOH溶液至溶液呈中性,则所得溶液中微粒浓度大小关系c(Na+)____c(NH3·H2O)(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代化学测定有机物组成及结构的分析方法较多。下列有关说法正确的是
A.元素分析仪不仅可以测出试样常见的组成元素及含量,还可以测定其分子的空间结构
B.![]()
C.通过红外线光谱图分析可以区分乙醇和乙酸乙酯
D.质谱法和紫外光谱法不属于测定有机物组成和结构的现代分析方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是一种重要的二元弱酸,还是一种重要的还原剂。草酸及草酸盐在工农业生产及科学研究领域均有广泛应用。利用草酸及草酸盐的性质可测定人体血液中钙离子的浓度。方法如下:抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸,再用已知浓度的酸性KMnO4溶液滴定,使草酸转化成CO2逸出,根据消耗的KMnO4溶液的体积即可测定血液样品中Ca2+的浓度。
(1)写出草酸与酸性KMnO4溶液反应的离子方程式______________________________________ 。
(2)抽取血样10.00mL,经过上述处理后得到草酸,再用硫酸酸化的0.010mol/L KMnO4溶液滴定,确定反应达到终点的现象是_______________________________________________________。
(3)滴定结束共消耗12.00mL KMnO4溶液。则血液样品中Ca2+离子的浓度为______mg/mL。
(4)下列操作可能使所测定结果偏高的是_________。
A.酸式滴定管未用标准液润洗就直接注入酸性高锰酸钾溶液
B.滴定前盛放待测液的锥形瓶用蒸馏水洗净后未干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.滴定结束后读取标准液体积时,俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸橙花酯兼有橙花和玫瑰花香气,其结构简式如图。关于该有机物的叙述中正确的是
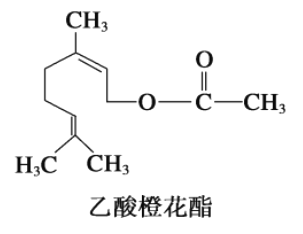
① 在Ni催化条件下1mol该有机物可与3mol H2发生加成;
② 该有机物不能发生银镜反应;
③ 该有机物分子式为C12H22O2;
④ 该有机物的同分异构体中不可能有酚类;
⑤ 1 mol该有机物水解时只能消耗1 mol NaOH
A. ②③④ B. ①④⑤ C. ②④⑤ D. ①②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com