
����Ŀ�����Ȼ���Ӧ��һ��ָ����Ԫ�����뻯�����еķ�Ӧ��һ������û��Ȼ����ӳ��Ȼ��������Ȼ�����֪����������ϩ��Ӧ���У� HC��CH (g)+HCl(g)![]() CH2=CHCl(g)�ķ�Ӧ������ͼ��ʾ��
CH2=CHCl(g)�ķ�Ӧ������ͼ��ʾ��

����˵����ȷ����
A.̼̼�����ļ��ܣ�M1С��CH��CH
B.����ͼ��֪M2��M3�ı仯����������ת��ɻ�ѧ�ܵĹ���
C.������ϩ��Ӧ���ܷ�Ӧ����ȡ����M2��M3�ķ�Ӧ����
D.HgCl2�ǡ��Ȼ���Ӧ���Ĵ�����������뷴Ӧ�Ĺ���
���𰸡�AC
��������
A. M1ΪHC��CH (g)��HgCl2�γɵ��м��壬����������ͷ�Ӧ�����ܣ��м���������ӳɷ�Ӧ�������ѻ�ѧ��������С�����M1��̼̼�����ļ���С����Ȳ��̼�����ļ��ܣ���A��ȷ��
B. ����ͼ��֪M2��M3�ı仯�����Ƿ��ȷ�Ӧ��Ӧ���ǻ�ѧ��ת��Ϊ���ܵĹ��̣���B����
C. ��Ӧ���ܷ�Ӧ������Ҫȡ���ڻ�ܴ�ķ�Ӧ����M2��M3�ķ�Ӧ����������ܷ�Ӧ����ȡ����M2��M3�ķ�Ӧ���ʣ���C��ȷ��
D. HgCl2�����Ȼ���Ӧ���Ĵ����������˻�ѧ��Ӧ����Ӧ�������䣬��D����
������������ΪAC��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��һ�ֳ����ĵ��ʣ�B��CΪ��ѧ��ѧ�����Ļ����A��B��C������Ԫ��X�����������µ�ת����ϵ�����ֲ��P��Ӧ��������ȥ���������ж���ȷ����
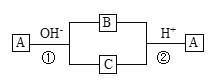
A.XԪ�ؿ���ΪAl
B.XԪ�ز�һ��Ϊ�ǽ���Ԫ��
C.��Ӧ�ٺ͢ڻ�Ϊ���淴Ӧ
D.��Ӧ�ٺ͢�һ��Ϊ������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij��Һ��ֻ����OH-��H+��NH4+��Cl-�������ӣ�ijͬѧ�Ʋ�������Ũ�ȴ�С˳�������¼���
��c��Cl-����c��NH4+����c��H+����c��OH-��
��c��Cl-����c��NH4+����c��OH-����c��H+��
��c��NH4+����c��Cl-����c��OH-����c��H+��
��c��Cl-����c��H+����c��NH4+����c��OH-��
��1��������ϵһ������ȷ����_______________������ţ���
��2������Һ��ֻ��һ�����ʣ��������Ϊ__________������Һ������Ũ�ȵĴ�С��ϵΪ_______������ţ���
��3������ϵ����ȷ������Һ������Ϊ_________��
��4������������Ũ�ȹ�ϵ��c��NH4+��=c��Cl-���������Һ��_________������������������������������������
��5��25����pH=a������VamL��pH=14-a�İ�ˮVbmL��ϣ�����Һ�����ԣ���Va__________Vb���������=����ȷ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�������ۺϴ�����NH4+ ��ˮ��ҵ��������Ҫ��N2��CO2��SO2��NO��CO�������������ɷ֣���������������̣�
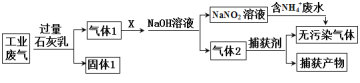
����˵������ȷ����
A.X�����ǹ����Ŀ���
B.����1����Ҫ����Ca(OH)2��CaCO3��CaSO3
C.������������������Ҫ��CO
D.������NH4+ ��ˮ,ÿ����1mol����Ⱦ����ת��3NA����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����84����Һ������Ҫ���ڻ�����������������ĺ�������������Ч�ɷ���NaClO��ij�о�С��̽��NaClO��Һ�����ʣ����������ʵ�飺
װ��ͼ | �Լ�X | ʵ������ | |
| �� | 0.2mol��L-1���� | ������������ɫ���� |
�� | 0.2mol��L-1KI��������Һ | ��Һ���� | |
�� | 0.2mol��L-1FeSO4(H+)��KSCN�����Һ | ��Һ��� | |
�� | 0.2mol��L-1AlCl3��Һ | ������ɫ���� | |
�����жϲ���ȷ����
A.ʵ����з�������Ҫ��Ӧ��ClO- +Cl- +2H+��Cl2��+H2O
B.ʵ����з�������Ҫ��Ӧ��ClO- +2I-+2H+��Cl-+I2+H2O
C.ʵ����и�������������ǿ��ClO- >Fe3+
D.ʵ�����ClO-��Al3+��ٽ�ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���۲�����װ�ã��ش��������⡣
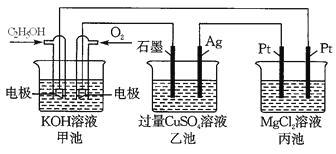
(1) ��װ����ͨ���Ҵ��ĵ缫��ӦʽΪ_______________________________________��
(2) ����ͼװ�õ��200 mL 1mol/L CuSO4��Һ��ʯī�缫�ϵĵ缫��Ӧʽ��________����Ag�缫�����۲쵽��������_____________________________��
(3) ���һ��ʱ�䣬���׳�������112 mLO2(�����)����ʱ��װ������Һ��pHΪ_______(���Ե��ǰ������仯)����Ҫ������Һ��ȫ�ָ������ǰ��Ũ�Ⱥ�pH����Ҫ�����������_____________�������ʵ���Ϊ___________��
(4) ��װ�����ܷ�Ӧ�����ӷ���ʽΪ____________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������10mL0.1mol/LNaOH��Һ�м���0.1mol/L��һԪ��HA����ҺpH�ı仯������ͼ��ʾ������˵����ȷ���ǣ� ��

A.a����Һ�У�c(Na+)>c(A-)>c(H+)>c(HA)
B.a��c������Һ��ˮ�ĵ���̶���ͬ
C.b����Һ�У�c(Na+)=c(A-)+c(HA)
D.c����Һ�У�c(A-)>c(HA)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����0.100mol/L��NaOH��Һ�ζ�20.00ml��0.100mol/L��HNO2��Һ��lg![]() ������NaOH��Һ����Ĺ�ϵ��ͼ��ʾ������˵���������
������NaOH��Һ����Ĺ�ϵ��ͼ��ʾ������˵���������
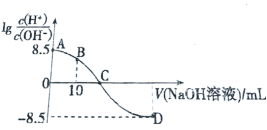
A.25��ʱ����0.100mol/L��HNO2��Һ��pHֵΪ2.75
B.B���Ӧ����Һ�У�2c(H+)+c(HNO2)=c(NO2-)+2c(OH-)
C.C���Ӧ��Һ��PH=7������NaOH��Һ�����Ϊ20.00ml
D.�ζ������д�A��D����Һ��ˮ�ĵ���̶���������С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ����Ҫ�Ļ���ԭ�ϣ���ҵ�������������Ƶ����ƣ��Ʊ����Ƶķ�Ӧԭ��Ϊ��Na2SO4��s��+4H2��g��Na2S��s��+4H2O��g����Q����֪�ÿ��淴Ӧ��1000��ʱ�ﵽƽ�⣬�����ַ�Ӧ���ں��º��ݣ��Իش��������⣺
��1���˿��淴Ӧ��ƽ�ⳣ������ʽ�ɱ�ʾΪ______����ֻ�ı�һ��Ӱ�����أ���ƽ���ƶ�ʱ��Kֵ______�仯������һ����������һ����������Kֵ���ʱ���淴Ӧ����______��������������������С��������������
��2���÷�Ӧ�ﵽƽ��ʱ����˵���������______��
a��������ѹǿ���ֲ���
b��������ˮ���������ʵ���֮�ȱ��ֲ���
c����������Fe3O4���壬ƽ�����淴Ӧ�����ƶ�
d���Ƴ�����Na2S���壬ƽ��������Ӧ�����ƶ�
��3�����¶��£���2Lʢ��2.84g Na2SO4���ܱ�������ͨ��H2���壬10���Ӻ��ù�������Ϊ2.264g����10������H2��ƽ����Ӧ����Ϊ______��
��4����Ba��ClO��2��Һ��ͨ������SO2�������Һ�е�������______��
��5�������������еμӷ�̪����Һ��Ϊ��ɫ�����ڸ���Һ���ٵ��������BaCl2��Һ��������______���������ӷ���ʽ������ƽ��ԭ�����н��ͣ�______��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com