

分析 A可与二氧化碳反应生成沉淀,则A应为NaAlO2和Na2SiO3,可知试剂①为NaOH溶液,沉淀B为Fe2O3,沉淀D为Al(OH)3和H2SiO3,滤液C为NaAlO2和Na2SiO3,溶液C为碳酸氢钠溶液,加入CaO,反应生成NaOH和CaCO3沉淀,E为NaOH,可循环使用,F为Al2O3和SiO2,电解可生成Al,以此解答该题.
解答 解:A可与二氧化碳反应生成沉淀,则A应为NaAlO2,可知试剂①为NaOH溶液,沉淀B为Fe2O3,沉淀D为Al(OH)3和H2SiO3,滤液C为NaAlO2和Na2SiO3,溶液C为碳酸氢钠溶液,加入CaO,反应生成NaOH和CaCO3沉淀,E为NaOH,可循环使用,F为Al2O3和SiO2,电解可生成Al,
(1)由以上分析可知①为NaOH溶液,反应①②③在溶液中进行,不消耗能量,而④为电解熔融的氧化铝,消耗热能和电能,则消耗能量最多,
故答案为:NaOH溶液;④;
(2)转化①Al2O3、SiO2与NaOH反应,而Fe2O3不与NaOH反应,反应的化学方程式为:Al2O3+2NaOH═2NaAlO2+H2O、SiO2+2NaOH═Na2SiO3+H2O,
故答案为:Al2O3+2NaOH═2NaAlO2+H2O、SiO2+2NaOH═Na2SiO3+H2O;
(3)A为NaAlO2和Na2SiO3,通入二氧化碳反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-、SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-、SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-;
(4)流程中用到二氧化碳和氧化钙,而碳酸钙在加热时可分解生成,可循环使用,故答案为:CaO、CO2.
点评 本题考查混合物分离提纯方法的综合应用,为高频考点,把握流程中的反应及化学反应方程式书写为解答的关键,侧重分析、实验能力及化学用语的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 阳离子不一定是金属离子,含阳离子的物质一定含阴离子 | |
| B. | 阴、阳离子相互反应不一定形成离子化合物 | |
| C. | 共价化合物均属于弱电解质 | |
| D. | 由某金属元素的阳离子和某非金属元素阴离子组成的物质一定是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,正反应速率增大,化学平衡常数增大 | |
| B. | 减小压强,逆反应速率减小,化学平衡常数减小 | |
| C. | 加入催化剂,正逆反应速率不变,平衡不移动 | |
| D. | 充入氧气,正反应速率先增大后减小,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| n/mol t/min | NO | N2 | CO2 |
| 0 | 2.00 | 0 | 0 |
| 10 | 1.16 | 0.42 | 0.42 |
| 20 | 0.80 | 0.60 | 0.60 |
| 30 | 0.80 | 0.60 | 0.60 |
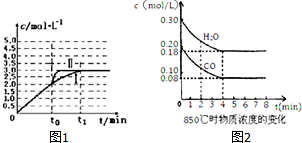
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
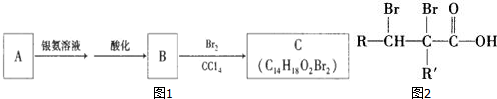
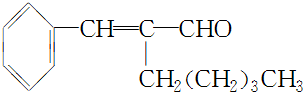 .
. +CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$
+CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$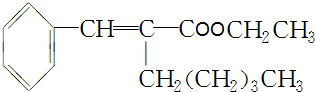 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.请回答下列问题:
甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.请回答下列问题:| 实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) |
| l | 150 | 1/3 | 0.1 |
| 2 | n | 1/3 | 5 |
| 3 | 350 | m | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5 种 | B. | 6 种 | C. | 7 种 | D. | 8 种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com