
【题目】将等物质的量的A和B,混合于2 L的密闭容器中,发生如下反应:3A(g)+B(g)=xC(g)+2D(g),经过5 min反应,测得D的浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,C的反应速率是0.1 mol·L-1·min-1,试求:
(1)x的值是________;
(2)A在5 min时的浓度是___;
(3)5 min 内B的平均反应速率是_____;
(4)A转化率是____;
(5)容器内在5 min时与开始时的压强比为_____________。
【答案】2 0.75 mol·L-1 0.05 mol·L-1·min-1 50% 1:1
【解析】
(1)由C的速率计算C的浓度变化量,利用浓度变化量之比等于化学计量数之比计算x;
(2)由方程式可知物质变化的物质的量浓度比等于方程式中化学计量数的比,再利用5 min时A、B浓度之比计算A的起始浓度,5 min末A的浓度=A的起始浓度-△c(A);
(3)利用速率之比等于化学计量数之比计算v(B);
(4)根据A转化率=![]() ×100%计算;
×100%计算;
(5)根据气体的体积比等于气体的压强比分析。
(1)反应进行到5 min时,C的反应速率是0.1 mol·L-1·min-1,则△c(C)=0.1 mol·L-1·min-1×5 min=0.5 mol/L,由于物质反应时浓度变化量之比等于方程式中化学计量数之比,则x:2=0.5 mol/L:0.5 mol/L,解得x=2;
(2)由方程式可知△c(A)=![]() △c(D)=
△c(D)=![]() ×0.5 mol/L=0.75 mol/L,△c(B)=
×0.5 mol/L=0.75 mol/L,△c(B)=![]() △c(D)=
△c(D)=![]() ×0.5 mol/L=0.25 mol/L,假设反应开始时A、B起始浓度相等设为c mol/L,则(c-0.75):(c-0.25)=3:5,解得c=1.5 mol/L,故5 min末A的浓度c(A)=1.5 mol/L-0.75 mol/L=0.75 mol/L;
×0.5 mol/L=0.25 mol/L,假设反应开始时A、B起始浓度相等设为c mol/L,则(c-0.75):(c-0.25)=3:5,解得c=1.5 mol/L,故5 min末A的浓度c(A)=1.5 mol/L-0.75 mol/L=0.75 mol/L;
(3)速率之比等于化学计量数之比,则v(B)=![]() v(C)=0.05 mol/(Lmin);
v(C)=0.05 mol/(Lmin);
(4)A的转化率=![]() ×100%=50%;
×100%=50%;
(5)根据(1)计算可知x=2,则该反应是反应前后气体体积不变的反应,由于在相同条件下气体的压强比等于气体的物质的量的比,所以容器内在5 min时气体的物质的量与反应前仍然相等,故容器内气体的压强与反应开始时的压强比为1:1。


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
【题目】![]() 下列过程中不一定释放能量的是 ______
下列过程中不一定释放能量的是 ______ ![]() 请填编号
请填编号![]()
A 形成化学键,![]() 燃料燃烧,
燃料燃烧,![]() 化合反应,
化合反应,![]() 葡萄糖在体内的氧化分解,
葡萄糖在体内的氧化分解,![]() 酸碱中和,
酸碱中和,![]() 炸药爆炸.
炸药爆炸.
![]() 已知A和B是同种元素的两种单质,A转化为B时需放出能量,则A和B相比较而言,较稳定的是 ______
已知A和B是同种元素的两种单质,A转化为B时需放出能量,则A和B相比较而言,较稳定的是 ______ ![]() 请填A或
请填A或![]() .
.
![]() 在
在![]() C、
C、![]() C、
C、![]() 、
、![]() 几种核素中,互称为同位素的是 ______
几种核素中,互称为同位素的是 ______
![]() 下列五种有机物中:
下列五种有机物中:![]()
![]()
![]()
![]()
![]() 淀粉,
淀粉,
水溶液显酸性的是 ______ ![]() 填编号
填编号![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中发生如下反应:X(g)+3Y(g)2Z(g);△H<0.上图表示该反应的速率(v)随时间
(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中不正确的是( )

A. ![]() 时加入了催化剂B.
时加入了催化剂B. ![]() 时降低了温度
时降低了温度
C. ![]() 时增大了压强D.
时增大了压强D. ![]() 时间内转化率最高
时间内转化率最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示两种晶体的微观结构:
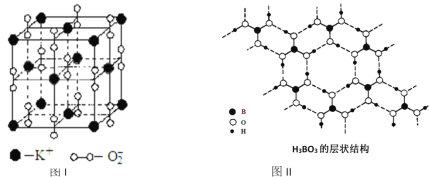
试回答下列有关问题:
(1)高温下,超氧化钾晶体呈立方体结构。晶体中氧的化合价部分为0价,部分为-2价。图I为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则晶体中,与每个K+距离最近的K+有_________个,0价氧原子与-2价氧原子的数目比为_________;
(2)正硼酸(H3BO3)是一种片层结构的白色晶体,层内的H3BO3分子通过氢键相连(如图II)。下列有关说法正确的有_________。
①正硼酸晶体属于原子晶体
②H3BO3分子的稳定性与氢键有关
③在H3BO3分子中各原子未能都满足8e-稳定结构
④含1molH3BO3的晶体中有3mol氢键
⑤含1molH3BO3的晶体中有3mol极性共价键
⑥晶体中每个B与相邻的3个O共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A. 乙烯与苯都能使溴水褪色,但褪色原理不同
B. 1 mol乙烯与Cl2完全加成,然后与Cl2发生取代反应,共消耗氯气 5mol
C. 溴水遇到乙醛溶液出现褪色现象,是因为发生了氧化反应
D. ![]() 与
与![]() 互为同分异构体
互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.按系统命名法,化合物![]() 的名称是2,3,5,5-四甲基-4,4-二乙基己烷
的名称是2,3,5,5-四甲基-4,4-二乙基己烷
B.等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等
C.苯和甲苯互为同系物,均能使KMnO4酸性溶液褪色
D.结构片段 的高聚物,其单体是苯酚和甲醛
的高聚物,其单体是苯酚和甲醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类生活离不开化学知识,下列叙述正确的是( )
A.双氧水、高锰酸钾溶液可以完全灭活埃博拉病毒,其消毒原理与漂白粉消毒饮用水的原理相同
B.用乙醚从黄花蒿中提取青蒿素是利用了氧化还原反应原理
C.在某爆炸事故救援现场,消防员发现存放金属钠、电石、甲苯二异氰酸酯等化学品的仓库起火,应立即用泡沫灭火器将火扑灭
D.钢化玻璃、有机玻璃、防弹玻璃均属于硅酸盐材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组的同学为了探究SO2和氯水的漂白性,设计如下实验装置。
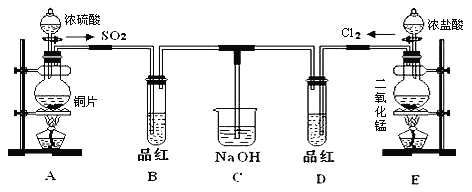
(1)写出A中反应的化学方程式__________,浓硫酸表现出__________性。
(2)实验室用装置E制备Cl2,离子方程式为:_____________该反应中的还原剂是_________(填化学式)。
(3)①装置A和E中,常用于萃取操作的仪器是__________(填名称)
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B:__________,D:__________.
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强.他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现品红溶液未褪色,并且生成了两种常见的强酸,请你分析该现象的原因:__________________(用化学方程式表示)。
(5)第三个实验小组同学查阅资料得知:氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品及精制的流程:
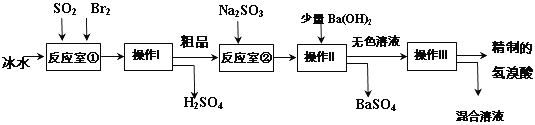
已知:Br 2是易挥发、深红棕色的液体,与Cl2化学性质相似;氢溴酸是易挥发、无色液体。
根据上述流程回答下列问题:
①反应室①使用冰水的目的___________。
②操作I的名称__________,操作Ⅱ的名称___________。
③反应室②中加入Na2SO3的目的是_____________。
④工业生产中制得的氢溴酸带有淡黄色。于是甲乙两同学设计了实验加以探究:
A.甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为_____________,若假设成立可观察到的现象为___________。
B.乙同学假设工业氢溴酸呈淡黄色是因为___________,其用于证明该假设成立的方法为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com