
【题目】某化学实验小组的同学为了探究SO2和氯水的漂白性,设计如下实验装置。
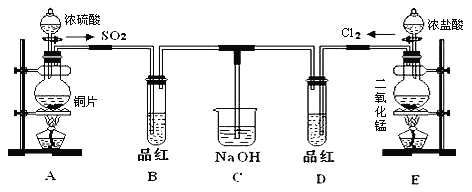
(1)写出A中反应的化学方程式__________,浓硫酸表现出__________性。
(2)实验室用装置E制备Cl2,离子方程式为:_____________该反应中的还原剂是_________(填化学式)。
(3)①装置A和E中,常用于萃取操作的仪器是__________(填名称)
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B:__________,D:__________.
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强.他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现品红溶液未褪色,并且生成了两种常见的强酸,请你分析该现象的原因:__________________(用化学方程式表示)。
(5)第三个实验小组同学查阅资料得知:氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品及精制的流程:
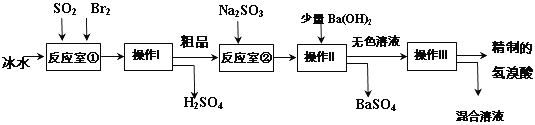
已知:Br 2是易挥发、深红棕色的液体,与Cl2化学性质相似;氢溴酸是易挥发、无色液体。
根据上述流程回答下列问题:
①反应室①使用冰水的目的___________。
②操作I的名称__________,操作Ⅱ的名称___________。
③反应室②中加入Na2SO3的目的是_____________。
④工业生产中制得的氢溴酸带有淡黄色。于是甲乙两同学设计了实验加以探究:
A.甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为_____________,若假设成立可观察到的现象为___________。
B.乙同学假设工业氢溴酸呈淡黄色是因为___________,其用于证明该假设成立的方法为____________。
【答案】Cu + 2H2SO4(浓)![]() CuSO4+ SO2↑+ 2H2O 酸性、强氧化性 MnO2+4H++2Cl—
CuSO4+ SO2↑+ 2H2O 酸性、强氧化性 MnO2+4H++2Cl—![]() Mn2++Cl2↑+2H2O HCl 分液漏斗 变红 不变色 SO2+Cl2+2H2O ==2HCl+H2SO4 降低体系温度,防止Br2挥发,使反应进行完全 蒸馏 过滤 除去粗产品中的Br2 KSCN 溶液变为血红色 溶解了少量Br2 加入CCl4进行萃取,若观察CCl4中有橙红色液体出现,可证明
Mn2++Cl2↑+2H2O HCl 分液漏斗 变红 不变色 SO2+Cl2+2H2O ==2HCl+H2SO4 降低体系温度,防止Br2挥发,使反应进行完全 蒸馏 过滤 除去粗产品中的Br2 KSCN 溶液变为血红色 溶解了少量Br2 加入CCl4进行萃取,若观察CCl4中有橙红色液体出现,可证明
【解析】
(1)在A中,Cu与浓硫酸混合加热发生反应产生硫酸铜、二氧化硫和水,反应的化学方程式Cu + 2H2SO4(浓)![]() CuSO4+ SO2↑+ 2H2O;在该反应中浓硫酸表现出酸性和强的氧化性。
CuSO4+ SO2↑+ 2H2O;在该反应中浓硫酸表现出酸性和强的氧化性。
(2)实验室用MnO2与浓盐酸混合加热制取Cl2,反应的离子方程式为MnO2+ 4H++ 2Cl—![]() Mn2++ Cl2↑+ 2H2O;在该反应中的还原剂是浓盐酸,化学式是HCl。
Mn2++ Cl2↑+ 2H2O;在该反应中的还原剂是浓盐酸,化学式是HCl。
(3)①装置A和E中,常用于萃取操作的仪器是分液漏斗;②停止通气后,再给B、D两个试管分别加热,由于SO2的漂白是结合漂白,产生的无色物质不稳定,受热分解,使物质恢复原来的颜色,而氯气与水发生反应产生的HClO的漂白是氧化漂白,产生的物质结构稳定,加热也不能分解而使其恢复原来的颜色,故两个试管中的现象分别为B:变红,D:不变色;
(4)将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现品红溶液未褪色,并且生成了两种常见的强酸,用化学方程式表示反应原理是:SO2+ Cl2+ 2H2O = 2HCl + H2SO4;
(5)①在反应室中发生反应:SO2+ Br2+ 2H2O =2HBr+ H2SO4,使用冰水的目的是降低体系温度,防止Br2挥发,使反应进行完全;
②操作I是分离互溶的沸点不同的液体混合物的方法,名称是蒸馏;操作Ⅱ是分离难溶性的固体与可溶性的液体混合物的方法,名称是过滤;
③反应室②中加入Na2SO3具有还原性,可以将未反应的Br2还原为HBr,除去粗产品中的Br2;
④A.甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为 KSCN溶液,若假设成立,二者会发生反应产生Fe(SCN)3,使溶液变为血红色;
B.乙同学假设工业氢溴酸呈淡黄色是因为少量Br2;用于证明该假设成立的方法可根据Br2容易溶解在有机物中,根据有机溶剂的颜色的不同鉴定,加入CCl4进行萃取,若观察CCl4中有橙红色液体出现,可证明含有Br2。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】将等物质的量的A和B,混合于2 L的密闭容器中,发生如下反应:3A(g)+B(g)=xC(g)+2D(g),经过5 min反应,测得D的浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,C的反应速率是0.1 mol·L-1·min-1,试求:
(1)x的值是________;
(2)A在5 min时的浓度是___;
(3)5 min 内B的平均反应速率是_____;
(4)A转化率是____;
(5)容器内在5 min时与开始时的压强比为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】造纸术是人类文明史上的一项重要发明,是书写材料的一次伟大变革。下列叙述错误的是( )
A.《墨子![]() 明鬼》“书之竹帛,传遗后世子孙”,帛的主要成分是蛋白质
明鬼》“书之竹帛,传遗后世子孙”,帛的主要成分是蛋白质
B.《后汉书》“伦乃造意,用树肤、麻头及敝布、鱼网以为纸”,树肤、麻头等富含纤维素
C.《十纸说》“川麻不浆,以胶(动物胶和明矾)作黄纸”,“胶”中的明矾作杀菌剂
D.《梦溪笔谈》“有误书处,以雌黄涂之”。雌黄涂盖,是利用雌黄与纸张颜色相近
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验探究小组研究320K时![]() 的分解反应:
的分解反应:![]() 。如图是该小组根据所给表格中的实验数据绘制的。下列有关说法正确的是( )
。如图是该小组根据所给表格中的实验数据绘制的。下列有关说法正确的是( )
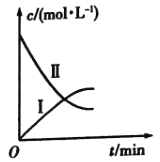
t/min | 0 | 1 | 2 | 3 | 4 |
| 0.160 | 0.114 | 0.080 | 0.056 | 0.040 |
| 0 | 0.023 | 0.040 | 0.052 | 0.060 |
A.曲线Ⅰ是![]() 的浓度变化曲线
的浓度变化曲线
B.曲线Ⅱ是![]() 的浓度变化曲线
的浓度变化曲线
C.![]() 的浓度越大,反应速率越快
的浓度越大,反应速率越快
D.![]() 的浓度越大,反应速率越快
的浓度越大,反应速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KMnO4是一种重要的消毒剂,俗名灰锰氧。某工厂以废旧的锌锰干电池为原料制备高锰酸钾的流程如下(各部分产物已省略):
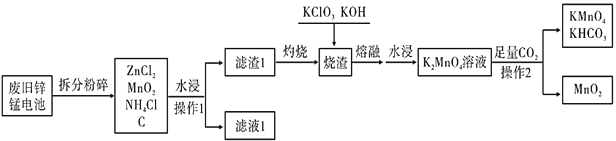
(1)这种锌锰电池放电时,负极的电极反应是_______________________________。
(2)滤渣1灼烧的目的是______________________________;可循环利用的物质是_________________(填化学式)。
(3) “水浸”采用适当加热,搅拌等措施,其目的是_________________________。熔融滤渣可能产生大气污染物是________________(填化学式) 。
(4)向![]() 溶液中通入足量CO2的离子方程式:_______________________。
溶液中通入足量CO2的离子方程式:_______________________。
(5)工业上,以石墨为电极电解K2MnO4溶液制备KMnO4,阳极的电极反应式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用硫酸渣(主要含Fe2O3、SiO2)制备纳米Fe3O4的工艺流程如下:
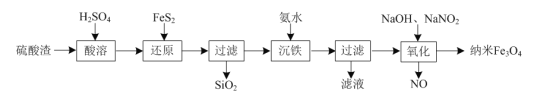
(1)“还原”时FeS2被氧化为SO![]() ,该反应的离子方程式为:_____。
,该反应的离子方程式为:_____。
(2)“沉铁”过程中的离子反应方程式为:______。
(3)“氧化”过程中的离子方程式为:________。
(4)一定条件下以Fe片作阳极、石墨作阴极电解NaCl溶液也可制得纳米Fe3O4,写出该反应的化学方程式:_________。
(5)有氧条件下,NO可被NH3催化还原为N2和H2O。当n(NO)∶n(O2)=4∶1时,该反应的化学方程式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.用醋酸溶解大理石:CaCO3+2H+=Ca2++H2O+CO2↑
B.向氨水中通入足量SO2气体:SO2+NH3·H2O=NH![]() +HSO
+HSO![]()
C.FeO溶于稀硝酸:FeO+2H+=Fe2++H2O
D.电解氯化镁溶液:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物 G 是一种黄烷酮类药物。下列说法正确的是
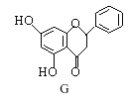
A.G分子中含有三种含氧官能团
B.G分子中含有2个手性碳原子
C.G可发生加成反应和水解反应
D.1 mol G与溴水反应,最多消耗2 mol Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸厂废气中SO2的回收利用方案如图所示,下列说法不正确的是
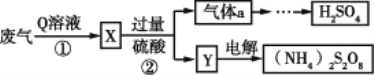
A.Q溶液是氨水
B.工业生产中气体a可通过两步反应转化为H2SO4
C.电解过程中被氧化的元素是硫
D.设计步骤①、②是为了富集SO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com