
【题目】KMnO4是一种重要的消毒剂,俗名灰锰氧。某工厂以废旧的锌锰干电池为原料制备高锰酸钾的流程如下(各部分产物已省略):
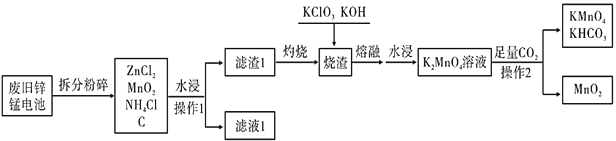
(1)这种锌锰电池放电时,负极的电极反应是_______________________________。
(2)滤渣1灼烧的目的是______________________________;可循环利用的物质是_________________(填化学式)。
(3) “水浸”采用适当加热,搅拌等措施,其目的是_________________________。熔融滤渣可能产生大气污染物是________________(填化学式) 。
(4)向![]() 溶液中通入足量CO2的离子方程式:_______________________。
溶液中通入足量CO2的离子方程式:_______________________。
(5)工业上,以石墨为电极电解K2MnO4溶液制备KMnO4,阳极的电极反应式为______________________。
【答案】![]() 除去碳粉
除去碳粉 ![]() 提高水浸速率和浸取率
提高水浸速率和浸取率 ![]()
![]()
![]()
【解析】
废旧锌锰电池的成分已给出,水浸后分成了滤液和滤渣,则操作I是过滤,得到的是氯化锌和氯化铵溶液,沉淀中有碳粉和二氧化锰,灼烧滤渣I的过程中,碳转变为二氧化碳逸出,烧渣再与氯酸钾、氢氧化钾熔融条件下反应,得到锰酸钾,通入足量的二氧化碳后,+6价的锰发生歧化反应,一部分变成+4价的二氧化锰沉淀,一部分变成+7价的高锰酸钾,则操作2仍然是过滤,据此来分析本题即可。
(1)电池中有![]() ,因此是酸性锌锰干电池,表面的锌皮作负极,负极反应为
,因此是酸性锌锰干电池,表面的锌皮作负极,负极反应为![]() ;
;
(2)根据分析,灼烧的目的是除去混合物中的碳粉,最后经操作2过滤后可以得到![]() ,这些
,这些![]() 可以循环利用;
可以循环利用;
(3)加热和搅拌,都是常见的加速溶解的措施,因此答案为提高水浸速率和可溶物的浸取率,在反应中![]() 作氧化剂被还原,因此有可能被还原为
作氧化剂被还原,因此有可能被还原为![]() ,
,![]() 可造成大气污染;
可造成大气污染;
(4)注意![]() 不参与氧化还原反应,仅仅是锰元素的歧化,写出离子方程式:
不参与氧化还原反应,仅仅是锰元素的歧化,写出离子方程式:![]() ;
;
(5)由![]() 到
到![]() 需要失电子,而电解池的阳极发生的就是失电子反应,因此阳极反应式为:
需要失电子,而电解池的阳极发生的就是失电子反应,因此阳极反应式为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】如图表示两种晶体的微观结构:
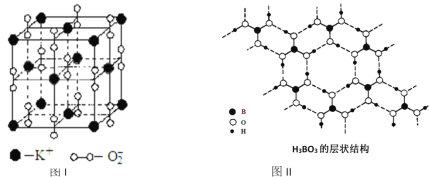
试回答下列有关问题:
(1)高温下,超氧化钾晶体呈立方体结构。晶体中氧的化合价部分为0价,部分为-2价。图I为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则晶体中,与每个K+距离最近的K+有_________个,0价氧原子与-2价氧原子的数目比为_________;
(2)正硼酸(H3BO3)是一种片层结构的白色晶体,层内的H3BO3分子通过氢键相连(如图II)。下列有关说法正确的有_________。
①正硼酸晶体属于原子晶体
②H3BO3分子的稳定性与氢键有关
③在H3BO3分子中各原子未能都满足8e-稳定结构
④含1molH3BO3的晶体中有3mol氢键
⑤含1molH3BO3的晶体中有3mol极性共价键
⑥晶体中每个B与相邻的3个O共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.工业上在高温条件下用铁和氧化铝制取金属铝
B.向新制氯水中加入少量碳酸钙粉末,能增强溶液的漂白性
C.纳米铁粉可以去除被污染水体中的Pb2+、Cu2+、Hg2+,利用了其还原性
D.硫元素在自然界的存在形式有硫单质、硫化物和硫酸盐等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NF3(三氟化氮)在常温常压下是无色、无味的气体,是微电子工业中一种优良的等离子蚀刻气体。回答下列问题:
(1)NF3的电子式为______,N元素的化合价为______。
(2)F2与NH3直接反应生成NF3的化学方程式为______。
(3)实验室模拟工业上利用电解熔融NH4HF2(NH4FHF)法制取NF3,阳极为以Ni为基本材料的合金(内含其他金属,忽略镍及其他金属的反应),阴极为碳素钢,电解废液可回收再利用。
①电解时NF3在______极生成;阴极产生的气体是______(填化学式)。
②电解后废液(含Ni少量Fe和Cu的单质及NH4HF2等)可经如下流程进行回收再利用:
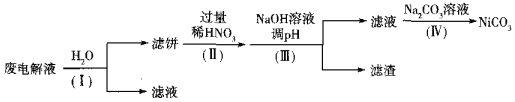
已知该实验条件下,部分金属离子开始沉淀与沉淀完全的pH如下表
金属离子 | Ni2+ | Fe2+ | Cu2+ | Fe3+ |
开始沉淀时的pH | 7.2 | 7.0 | 4.7 | 1.9 |
沉淀完全时的pH | 9.2 | 9.0 | 6.7 | 3.2 |
步骤I的目的是______;步骤Ⅱ滤饼中Ni溶于硝酸的离子方程式为______(HNO3的还原产物为NO);步骤Ⅲ调节pH时,理论上pH应控制的范围是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属和非金属被广泛应用于人类生产生活中。
(1)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用含有小苏打的药品以中和过多的胃酸,其反应的离子方程式:___________________________;
(2)中华透明牙膏摩擦剂SiO2是工业制备晶体硅的原料,工业上制粗硅的反应原理是 __________;(用化学反应方程式表示)。
(3)硅酸钠的水溶液俗称水玻璃,向其中通入过量的CO2,会出现胶状沉淀,其离子方程式是_________;
(4)人体血红蛋白中含有Fe2+,若误食亚硝酸盐,会导致Fe2+转化Fe3+而中毒,服用维生素C可以解毒.对上述的分析正确的是(______)
A.亚硝酸盐是还原剂 B.维生素C是氧化剂
C.维生素C被氧化 D.亚硝酸盐发生氧化反应
(5)化学与生产、生活、社会等密切相关,下列说法正确的是(_______)
A. 二氧化硫具有漂白性,可用来增白纸浆、草帽辫、食品等
B. 酸雨是空气中二氧化碳含量超标引起的
C.工业上合成氨气可用浓氨水和生石灰混合制得
D.蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性
E.洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一,漂白粉是常用的消毒剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组的同学为了探究SO2和氯水的漂白性,设计如下实验装置。
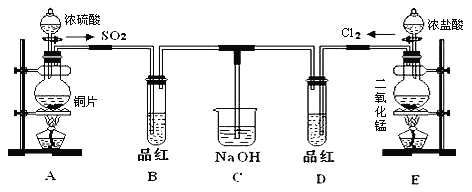
(1)写出A中反应的化学方程式__________,浓硫酸表现出__________性。
(2)实验室用装置E制备Cl2,离子方程式为:_____________该反应中的还原剂是_________(填化学式)。
(3)①装置A和E中,常用于萃取操作的仪器是__________(填名称)
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B:__________,D:__________.
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强.他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现品红溶液未褪色,并且生成了两种常见的强酸,请你分析该现象的原因:__________________(用化学方程式表示)。
(5)第三个实验小组同学查阅资料得知:氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品及精制的流程:
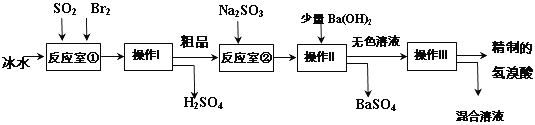
已知:Br 2是易挥发、深红棕色的液体,与Cl2化学性质相似;氢溴酸是易挥发、无色液体。
根据上述流程回答下列问题:
①反应室①使用冰水的目的___________。
②操作I的名称__________,操作Ⅱ的名称___________。
③反应室②中加入Na2SO3的目的是_____________。
④工业生产中制得的氢溴酸带有淡黄色。于是甲乙两同学设计了实验加以探究:
A.甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为_____________,若假设成立可观察到的现象为___________。
B.乙同学假设工业氢溴酸呈淡黄色是因为___________,其用于证明该假设成立的方法为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相对分子质量为92的某芳香烃X是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO。
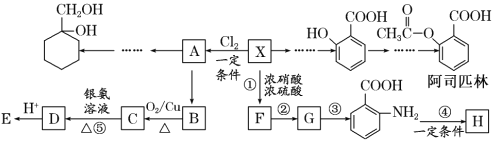
已知:Ⅰ.![]()
Ⅱ.![]() (苯胺,易被氧化)
(苯胺,易被氧化)
请根据所学知识与本题所给信息回答下列问题:
(1)X→A的反应条件是____。
(2)H的结构简式是____。
(3)反应③④的类型是____、____。
(4)反应⑤的化学方程式是____。
(5)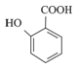 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有___种。
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有___种。
(6)请用合成反应流程图表示出由![]() 和其他无机物合成
和其他无机物合成![]() 的最合理的方案(不超过4步)__________。
的最合理的方案(不超过4步)__________。
例如:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 离子,分别取样,
离子,分别取样,![]() 测得溶液显弱碱性;
测得溶液显弱碱性;![]() 加入足量盐酸,有无色无味气体产生。为确定溶液组成,还需要检测的离子是
加入足量盐酸,有无色无味气体产生。为确定溶液组成,还需要检测的离子是![]()
![]()
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1L的密闭容器中,充入1mol CO2和3mol H2,在温度500℃时发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图,下列说法不正确的是
CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图,下列说法不正确的是
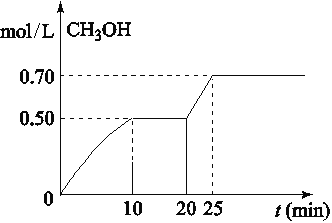
A. 从反应开始到10分钟时,H2的平均反应速率v(H2)=0.15 mol/(L·min)
B. 从20分钟到25分钟达到新的平衡,可能是增大压强
C. 其它条件不变,将温度升到800℃,再次达平衡时平衡常数减小
D. 从开始到25分钟,CO2的转化率是70%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com