
【题目】在容积为1L的密闭容器中,充入1mol CO2和3mol H2,在温度500℃时发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图,下列说法不正确的是
CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图,下列说法不正确的是
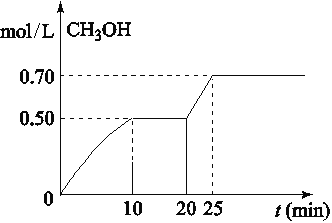
A. 从反应开始到10分钟时,H2的平均反应速率v(H2)=0.15 mol/(L·min)
B. 从20分钟到25分钟达到新的平衡,可能是增大压强
C. 其它条件不变,将温度升到800℃,再次达平衡时平衡常数减小
D. 从开始到25分钟,CO2的转化率是70%
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】KMnO4是一种重要的消毒剂,俗名灰锰氧。某工厂以废旧的锌锰干电池为原料制备高锰酸钾的流程如下(各部分产物已省略):
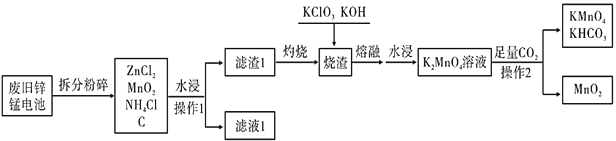
(1)这种锌锰电池放电时,负极的电极反应是_______________________________。
(2)滤渣1灼烧的目的是______________________________;可循环利用的物质是_________________(填化学式)。
(3) “水浸”采用适当加热,搅拌等措施,其目的是_________________________。熔融滤渣可能产生大气污染物是________________(填化学式) 。
(4)向![]() 溶液中通入足量CO2的离子方程式:_______________________。
溶液中通入足量CO2的离子方程式:_______________________。
(5)工业上,以石墨为电极电解K2MnO4溶液制备KMnO4,阳极的电极反应式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组欲测定KClO3,溶液与![]() 溶液反应的化学反应速率.所用试剂为10mL0.1mol/LKClO3,溶液和
溶液反应的化学反应速率.所用试剂为10mL0.1mol/LKClO3,溶液和![]() 溶液,所得数据如图所示。已知:
溶液,所得数据如图所示。已知:![]() 。
。
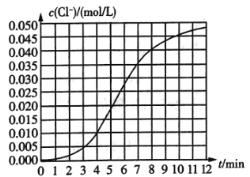
(1)根据实验数据可知,该反应在0~4min内的平均反应速率![]() ________
________![]() 。
。
(2)某同学仔细分析实验数据后发现,在反应过程中,该反应的化学反应速率先增大后减小.某小组同学针对这一现象进一步探究影响该化学反应速率的因素,具体方法如表示。
方案 | 假设 | 实验操作 |
Ⅰ | 该反应放热使溶液温度升高,反应速率加快 | 向烧杯中加入10mL0.1mo//L的 |
Ⅱ | 取10mL0.1mo/L的 | |
Ⅲ | 溶液酸性增强加快了化学反应速率 | 分别向a、b两只烧杯中加入10mL0.1mol/L的 |
①补全方案Ⅰ中的实验操作:________。
②方案Ⅱ中的假设为________。
③除Ⅰ、Ⅱ、Ⅲ中的假设外,还可以提出的假设是________。
④某同学从控制变量的角度思考,认为方案Ⅲ中实验操作设计不严谨,请进行改进:________。
⑤反应后期,化学反应速率变慢的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验兴趣小组按下图装置实验后,所记录内容合理的是( )
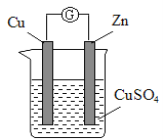
实验 记录 | ① Cu为正极,Zn为负极; ② Zn质量减少,Cu质量增加; ③ SO ④ 电子流方向是:由Zn经导线流入Cu片; ⑤ Zn电极发生还原反应; ⑥ 正极反应式:Cu2+ + 2e- = Cu |
A.②③④ B.①②④⑥ C.①②④⑤ D.②③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X是一种重要的有机合成中间体,用于制造塑料、涂料和黏合剂等高聚物。为研究X的组成与结构,进行了如下实验:
(1)有机物X的质谱图:
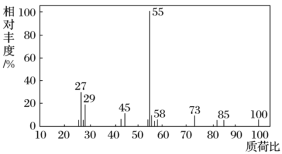
有机物X的相对分子质量是__________。
(2)将10.0 g X在足量O2中充分燃烧,并使其产物依次通过足量的无水CaCl2和KOH浓溶液,发现无水CaCl2增重7.2 g,KOH浓溶液增重22.0 g。有机物X的分子式是________________。
(3)经红外光谱测定,有机物X中含有醛基;有机物X的核磁共振氢谱图上有2个吸收峰,峰面积之比是3∶1。有机物X的结构简式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸厂废气中SO2的回收利用方案如图所示,下列说法不正确的是
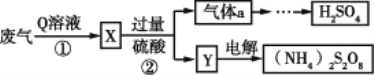
A.Q溶液是氨水
B.工业生产中气体a可通过两步反应转化为H2SO4
C.电解过程中被氧化的元素是硫
D.设计步骤①、②是为了富集SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟基扁桃酸是药物合成的重要中间体,它可由苯酚和乙醛酸反应制得
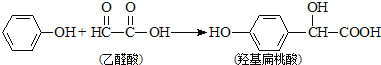
下列有关说法正确的是
A. 苯酚和羟基扁桃酸互为同系物
B. 标准状况下,22.4L羟基扁桃酸中共用电子对的数目为24NA
C. 乙醛酸只存在一种不同环境的氢原子
D. 羟基扁桃酸分子中至少有12个原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯二氧化硅可用来制造光纤。某蛇纹石的成分见下表:
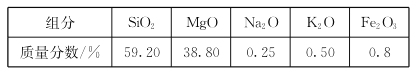
通过下图流程可由蛇纹石制备较纯净的二氧化硅。
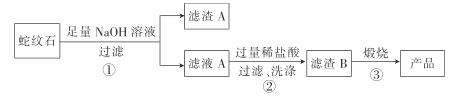
(1)蛇纹石中涉及的可溶性金属氧化物有___________________(写化学式)。
(2)步骤①中涉及SiO2 反应的离子方程式为_________________________ 。
(3)滤渣 A的成分有__________________ (填化学式)。
(4)步骤②中洗涤沉淀的方法是 _____________________________________________。
(5)步骤③反应的化学方程式为 _______________________________________;实验室进行步骤③需要用到的仪器有坩埚、泥三角、酒精灯、玻璃棒、________和____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料,其制备途径及性质如图所示(假设恰好完全反应)。下列说法正确的是
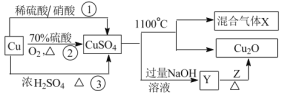
A.途径①所用混酸中,H2SO4与 HNO3物质的量之比为2:3
B.1molCuSO4在 1100℃所得混合气体中,O2为 0.75mol
C.Z 只能是葡萄糖
D.相对于途径①、③,途径②更好地体现了绿色化学思想
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com