
【题目】某化学兴趣小组欲测定KClO3,溶液与![]() 溶液反应的化学反应速率.所用试剂为10mL0.1mol/LKClO3,溶液和
溶液反应的化学反应速率.所用试剂为10mL0.1mol/LKClO3,溶液和![]() 溶液,所得数据如图所示。已知:
溶液,所得数据如图所示。已知:![]() 。
。
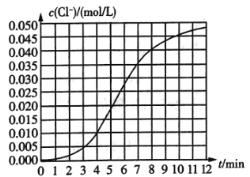
(1)根据实验数据可知,该反应在0~4min内的平均反应速率![]() ________
________![]() 。
。
(2)某同学仔细分析实验数据后发现,在反应过程中,该反应的化学反应速率先增大后减小.某小组同学针对这一现象进一步探究影响该化学反应速率的因素,具体方法如表示。
方案 | 假设 | 实验操作 |
Ⅰ | 该反应放热使溶液温度升高,反应速率加快 | 向烧杯中加入10mL0.1mo//L的 |
Ⅱ | 取10mL0.1mo/L的 | |
Ⅲ | 溶液酸性增强加快了化学反应速率 | 分别向a、b两只烧杯中加入10mL0.1mol/L的 |
①补全方案Ⅰ中的实验操作:________。
②方案Ⅱ中的假设为________。
③除Ⅰ、Ⅱ、Ⅲ中的假设外,还可以提出的假设是________。
④某同学从控制变量的角度思考,认为方案Ⅲ中实验操作设计不严谨,请进行改进:________。
⑤反应后期,化学反应速率变慢的原因是________。
【答案】0.0025 插入温度计 生成的![]() 加快了化学反应速率 生成的
加快了化学反应速率 生成的![]() 加快了化学反应速率 将1mL水改为1mL0.2mol/L的NaCl溶液 反应物浓度降低
加快了化学反应速率 将1mL水改为1mL0.2mol/L的NaCl溶液 反应物浓度降低
【解析】
(1)根据实验数据可知,该反应在0~4min内生成氯离子的浓度是0.010mol/L,所以平均反应速率![]() ;
;
(2)①由于是假设该反应放热,使溶液温度升高,反应速率加快,因此需要测量反应过程中溶液温度的变化;
②方案I、Ⅱ相比较,Ⅱ中加入了少量氯化钠,所以方案Ⅱ中的假设为生成的![]() 加快了化学反应速率;
加快了化学反应速率;
③由于反应中还有硫酸根离子生成,则除I、Ⅱ、Ⅲ中的假设外,还可以提出的假设是生成的硫酸根离子加快了化学反应速率;
④为防止氯离子对实验的干扰,则改进措施是将1mL水改为1mL0.2mol/L的NaCl溶液;
⑤反应后期反应物浓度减小,因此化学反应速率变慢。


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.工业上在高温条件下用铁和氧化铝制取金属铝
B.向新制氯水中加入少量碳酸钙粉末,能增强溶液的漂白性
C.纳米铁粉可以去除被污染水体中的Pb2+、Cu2+、Hg2+,利用了其还原性
D.硫元素在自然界的存在形式有硫单质、硫化物和硫酸盐等
查看答案和解析>>
科目:高中化学 来源: 题型:
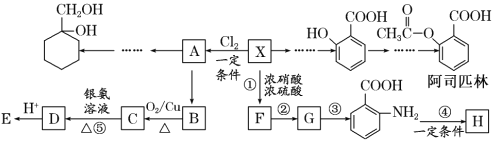
【题目】相对分子质量为92的某芳香烃X是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO。
已知:Ⅰ.![]()
Ⅱ.![]() (苯胺,易被氧化)
(苯胺,易被氧化)
请根据所学知识与本题所给信息回答下列问题:
(1)X→A的反应条件是____。
(2)H的结构简式是____。
(3)反应③④的类型是____、____。
(4)反应⑤的化学方程式是____。
(5)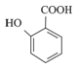 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有___种。
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有___种。
(6)请用合成反应流程图表示出由![]() 和其他无机物合成
和其他无机物合成![]() 的最合理的方案(不超过4步)__________。
的最合理的方案(不超过4步)__________。
例如:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 离子,分别取样,
离子,分别取样,![]() 测得溶液显弱碱性;
测得溶液显弱碱性;![]() 加入足量盐酸,有无色无味气体产生。为确定溶液组成,还需要检测的离子是
加入足量盐酸,有无色无味气体产生。为确定溶液组成,还需要检测的离子是![]()
![]()
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某化学兴趣小组制备PCl3的实验装置(部分仪器已省略):
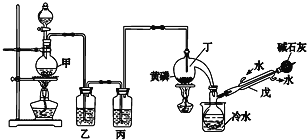
有关物质的部分性质如下:
熔点/℃ | 沸点/℃ | 其他 | |
黄磷 | 44.1 | 280.5 | 2P(过量)+3Cl2 |
PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl,能溶于PCl3 |
请回答下列问题:
(1)仪器戊的名称为___。
(2)实验时甲中所发生反应的化学方程式为___。
(3)乙中盛放的试剂是___,其作用是___;丙中盛放的试剂是___,其作用是___。
(4)向仪器丁中通入干燥、纯净的Cl2之前,应先通入一段时间的CO2,其目的主要是___。
(5)碱石灰的作用是___(答出一条即可)。
(6)PCl3粗产品中常含有POCl3、PCl5等,加入黄磷(化学式用P表示)经加热除去PCl5的化学反应方程式为___,后通过___(填实验操作名称),即可得到PCl3纯品。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把1 mol X气体和0.5 mol Y气体混合于2 L密闭容器中,发生如下反应:3X(g)+Y(g)![]() nZ(g)+2W(g),2 min末生成0.2 mol W,若测得以Z的物质的量浓度变化表示的平均反应速率为0.1mol/(L·min),试计算:
nZ(g)+2W(g),2 min末生成0.2 mol W,若测得以Z的物质的量浓度变化表示的平均反应速率为0.1mol/(L·min),试计算:
(1)前2 min内,用X表示的平均反应速率________;
(2)2 min末时Y的转化率________;
(3)化学方程式中Z的化学计量数n________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁系元素是人体必需的微量元素, Fe3+可以与KSCN溶液、苯酚等发生显色作用。镁元素也是人体所必需的阳离子元素之一,它能够维持核酸结构的稳定性,调节机体免疫功能,对人体抵抗新冠病毒等病毒侵袭起着重要作用。
(1)与SCN互为等电子体且为非极性分子的化学式为__________(任写一种)。
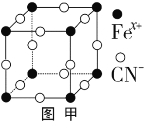
(2)普鲁士蓝俗称铁蓝,晶胞如图甲所示(K+未画出),平均每两个晶胞立方体中含有一个K+,又知该晶体中铁元素有+2价和+3价两种,则Fe3+与Fe2+的个数比为___________。
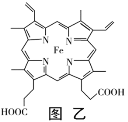
(3)血红素铁(图乙)用作铁强化剂,其吸收率比一般铁剂高3倍,在图乙中画出Fe2+与N原子间的化学键(若是配位键,需要用箭头加以表示)_____________
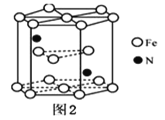
(4)某种磁性氮化铁的结构如图2所示,Fe为____________堆积,N随机排列在Fe构成的正四面体空隙中,空隙的占有率为![]() ,则该化合物的化学式为___________。 其中铁原子最近的铁原子的个数为________;氮化铁晶胞底边长为a nm,高为c nm,则这种磁性氮化铁的晶体密度为______ g·cm-3 (用含a、c和NA的计算式表示)。
,则该化合物的化学式为___________。 其中铁原子最近的铁原子的个数为________;氮化铁晶胞底边长为a nm,高为c nm,则这种磁性氮化铁的晶体密度为______ g·cm-3 (用含a、c和NA的计算式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1L的密闭容器中,充入1mol CO2和3mol H2,在温度500℃时发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图,下列说法不正确的是
CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图,下列说法不正确的是
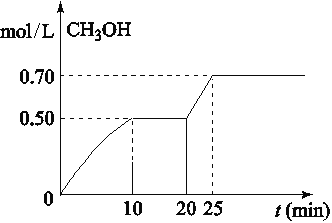
A. 从反应开始到10分钟时,H2的平均反应速率v(H2)=0.15 mol/(L·min)
B. 从20分钟到25分钟达到新的平衡,可能是增大压强
C. 其它条件不变,将温度升到800℃,再次达平衡时平衡常数减小
D. 从开始到25分钟,CO2的转化率是70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列描述正确的是
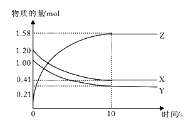
A.反应开始到10s,用Z表示的平均反应速率为0.158 mol/(L·s)
B.反应开始到10s,X的物质的量浓度减少了0.79 mol/L
C.反应的化学方程式为:X(g)+Y(g)![]() Z(g)
Z(g)
D.反应开始到10s时,Y的转化率为79.0%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com