
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列描述正确的是
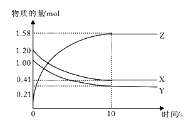
A.反应开始到10s,用Z表示的平均反应速率为0.158 mol/(L·s)
B.反应开始到10s,X的物质的量浓度减少了0.79 mol/L
C.反应的化学方程式为:X(g)+Y(g)![]() Z(g)
Z(g)
D.反应开始到10s时,Y的转化率为79.0%
【答案】D
【解析】
由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且△n(Y):△n(X):△n(Z)=0.79mol:0.79mol:1.58mol=1:1:2,最终各种物质都存在,且浓度不再变化,则反应的化学方程式为:X+Y![]() 2Z,据以上分析解答。
2Z,据以上分析解答。
A.反应开始到10s,Z的物质的量增加了1.58mol,用Z表示的反应速率为V(Z)= ![]() =
=![]() =0.079mol/(Ls),A错误;
=0.079mol/(Ls),A错误;
B.由图象可知反应开始到10s,X的物质的量浓度减少了![]() =0.395mol/L,B错误;
=0.395mol/L,B错误;
C.由以上分析可知反应的化学方程式为:X+Y![]() 2Z,C错误;
2Z,C错误;
D.反应开始到10s时,Y的转化率为![]() ×100%=79.0%,D正确;
×100%=79.0%,D正确;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】某化学兴趣小组欲测定KClO3,溶液与![]() 溶液反应的化学反应速率.所用试剂为10mL0.1mol/LKClO3,溶液和
溶液反应的化学反应速率.所用试剂为10mL0.1mol/LKClO3,溶液和![]() 溶液,所得数据如图所示。已知:
溶液,所得数据如图所示。已知:![]() 。
。
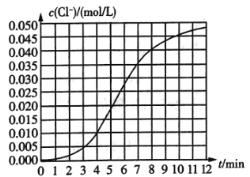
(1)根据实验数据可知,该反应在0~4min内的平均反应速率![]() ________
________![]() 。
。
(2)某同学仔细分析实验数据后发现,在反应过程中,该反应的化学反应速率先增大后减小.某小组同学针对这一现象进一步探究影响该化学反应速率的因素,具体方法如表示。
方案 | 假设 | 实验操作 |
Ⅰ | 该反应放热使溶液温度升高,反应速率加快 | 向烧杯中加入10mL0.1mo//L的 |
Ⅱ | 取10mL0.1mo/L的 | |
Ⅲ | 溶液酸性增强加快了化学反应速率 | 分别向a、b两只烧杯中加入10mL0.1mol/L的 |
①补全方案Ⅰ中的实验操作:________。
②方案Ⅱ中的假设为________。
③除Ⅰ、Ⅱ、Ⅲ中的假设外,还可以提出的假设是________。
④某同学从控制变量的角度思考,认为方案Ⅲ中实验操作设计不严谨,请进行改进:________。
⑤反应后期,化学反应速率变慢的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟基扁桃酸是药物合成的重要中间体,它可由苯酚和乙醛酸反应制得
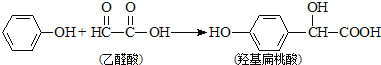
下列有关说法正确的是
A. 苯酚和羟基扁桃酸互为同系物
B. 标准状况下,22.4L羟基扁桃酸中共用电子对的数目为24NA
C. 乙醛酸只存在一种不同环境的氢原子
D. 羟基扁桃酸分子中至少有12个原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯二氧化硅可用来制造光纤。某蛇纹石的成分见下表:
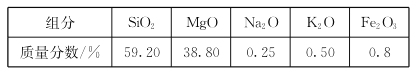
通过下图流程可由蛇纹石制备较纯净的二氧化硅。
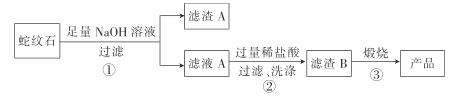
(1)蛇纹石中涉及的可溶性金属氧化物有___________________(写化学式)。
(2)步骤①中涉及SiO2 反应的离子方程式为_________________________ 。
(3)滤渣 A的成分有__________________ (填化学式)。
(4)步骤②中洗涤沉淀的方法是 _____________________________________________。
(5)步骤③反应的化学方程式为 _______________________________________;实验室进行步骤③需要用到的仪器有坩埚、泥三角、酒精灯、玻璃棒、________和____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的数值,下列叙述中正确的是
A.常温常压下,11.2 LNH3所含的原子数为2NA
B.标准状况下,22.4 LCl2所含的原子数为NA
C.常温常压下,80 gSO3所含的氧原子数为3NA
D.一定条件下,56 g铁与足量HNO3完全反应,转移电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)相同物质的量的①C2H4②C2H6O完全燃烧,消耗氧气物质的量关系为______(填编号,用“>”“<”或“=”表示).
(2)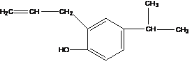 的分子式为____________.
的分子式为____________.
(3)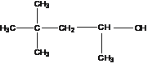 系统命名为____________________________.
系统命名为____________________________.
(4)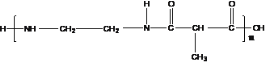 的单体为___________________.
的单体为___________________.
(5)3-甲基-1-丁醇消去的反应方程式________________________________.
(6)2-甲基-2-氯丙烷水解的反应方程式__________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组为探究和比较二氧化硫和氯水的漂白性,设计了如图所示的实验装置。
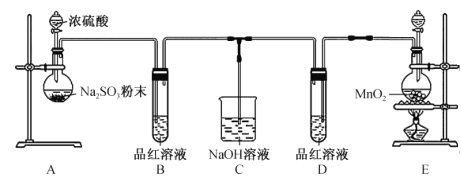
回答下列问题:
(1)装置A中反应的化学方程式为____________________________________;制备SO2时选用浓硫酸而不用稀硫酸的主要原因是 ____________________________。
(2)实验室用装置E制备C12,反应的离子方程式为 __________________________。若有8.7gMnO2参加反应,则转移的电子的物质的量为 ______________。
(3)反应开始一段时间后,观察到装置B、D中的品红溶液出现的现象是____________。
(4)小组中甲同学认为SO2和氯水都有漂白性,若二者混合使用,漂白性会更强。为验证甲同学的推断,在同温同压下,他们同时将SO2和C12等体积通入到品红溶液中,结果发现品红溶液_____________(填字母)。
a.很快褪色 b.几乎不褪色 c.先褪色后复原
出现上述现象的原因是________________________________ (用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料,其制备途径及性质如图所示(假设恰好完全反应)。下列说法正确的是
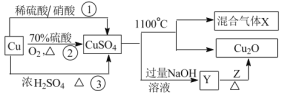
A.途径①所用混酸中,H2SO4与 HNO3物质的量之比为2:3
B.1molCuSO4在 1100℃所得混合气体中,O2为 0.75mol
C.Z 只能是葡萄糖
D.相对于途径①、③,途径②更好地体现了绿色化学思想
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜![]() ,白色、易被氧化,
,白色、易被氧化,![]() 广泛用作催化剂、媒染剂、脱色剂等。工业上用初级铜矿粉
广泛用作催化剂、媒染剂、脱色剂等。工业上用初级铜矿粉![]() 主要含
主要含![]() 、CuS、
、CuS、![]() 、FeO等
、FeO等![]() 制备活性CuCl的流程如下:
制备活性CuCl的流程如下:
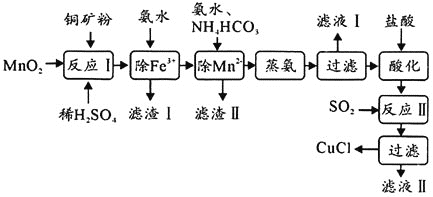
(1)滤渣Ⅰ是![]() 和单质硫的混合物,反应Ⅰ中
和单质硫的混合物,反应Ⅰ中![]() 参与反应的化学方程式为:
参与反应的化学方程式为:![]() 未配平
未配平![]() ,氧化产物为________。
,氧化产物为________。
(2)除![]() 时得
时得![]() 沉淀,该反应的离子方程式为________。
沉淀,该反应的离子方程式为________。
(3)已知![]() 可溶于氨水形成深蓝色溶液:
可溶于氨水形成深蓝色溶液:![]() 。蒸氨条件及蒸氨效果见下表:
。蒸氨条件及蒸氨效果见下表:
序号 | 温度 | 时间 | 压强 | 残液颜色 |
a | 110 | 60 |
| 浅蓝色 |
b | 100 | 40 |
| 几乎很浅 |
c | 90 | 30 |
| 无色透明 |
由表中信息可知蒸氨的条件应选________![]() 填序号
填序号![]() 。
。
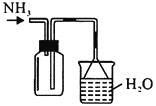
蒸出的氨气可以回收利用,在实验室用如图装置来收集。当集气瓶收集满氨气时观察到的现象是________。
(4)反应Ⅱ的离子方程式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com