
【题目】氯化亚铜![]() ,白色、易被氧化,
,白色、易被氧化,![]() 广泛用作催化剂、媒染剂、脱色剂等。工业上用初级铜矿粉
广泛用作催化剂、媒染剂、脱色剂等。工业上用初级铜矿粉![]() 主要含
主要含![]() 、CuS、
、CuS、![]() 、FeO等
、FeO等![]() 制备活性CuCl的流程如下:
制备活性CuCl的流程如下:
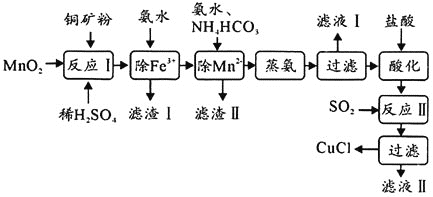
(1)滤渣Ⅰ是![]() 和单质硫的混合物,反应Ⅰ中
和单质硫的混合物,反应Ⅰ中![]() 参与反应的化学方程式为:
参与反应的化学方程式为:![]() 未配平
未配平![]() ,氧化产物为________。
,氧化产物为________。
(2)除![]() 时得
时得![]() 沉淀,该反应的离子方程式为________。
沉淀,该反应的离子方程式为________。
(3)已知![]() 可溶于氨水形成深蓝色溶液:
可溶于氨水形成深蓝色溶液:![]() 。蒸氨条件及蒸氨效果见下表:
。蒸氨条件及蒸氨效果见下表:
序号 | 温度 | 时间 | 压强 | 残液颜色 |
a | 110 | 60 |
| 浅蓝色 |
b | 100 | 40 |
| 几乎很浅 |
c | 90 | 30 |
| 无色透明 |
由表中信息可知蒸氨的条件应选________![]() 填序号
填序号![]() 。
。
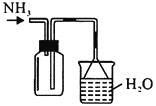
蒸出的氨气可以回收利用,在实验室用如图装置来收集。当集气瓶收集满氨气时观察到的现象是________。
(4)反应Ⅱ的离子方程式为________。
【答案】![]() 、S
、S ![]()
![]()
![]()
![]()
![]() 漏斗中的液面忽上忽下
漏斗中的液面忽上忽下 ![]()
![]()
![]()
![]()
【解析】
(1)该反应中![]() 发生氧化反应生成
发生氧化反应生成![]() 和S;
和S;
(2)除![]() 时加入氨水和
时加入氨水和![]() ,得
,得![]() 沉淀;
沉淀;
(3)根据表中信息,c得到的残液颜色为无色透明,说明![]() 转换率最大;
转换率最大;
实验室用题图装置收集满氨气时,氨气溶解使烧杯中液面上升,溶液进入漏斗,在重力作用下,溶液又会下落,如此反复;
(4)蒸氨后过滤得到![]() ,加入盐酸酸化得到
,加入盐酸酸化得到![]() 溶液,向
溶液,向![]() 溶液中通入
溶液中通入![]() 制得CuCl,
制得CuCl,![]() 被还原成CuCl,则
被还原成CuCl,则![]() 被氧化成
被氧化成![]() 。
。
(1)该反应中![]() 发生氧化反应生成
发生氧化反应生成![]() 和S,故氧化产物为
和S,故氧化产物为![]() 、S;故答案为:
、S;故答案为:![]() 、S;
、S;
(2)除![]() 时加入氨水和
时加入氨水和![]() ,得
,得![]() 沉淀,该反应的离子方程式为
沉淀,该反应的离子方程式为![]() ;故答案为:
;故答案为:![]() ;
;
(3)蒸氨的目的是使平衡![]() 向逆反应方向移动,根据表中信息,c得到的残液颜色为无色透明,说明
向逆反应方向移动,根据表中信息,c得到的残液颜色为无色透明,说明![]() 转换率最大,故蒸氨的条件应选c。实验室用题图装置收集满氨气时,氨气溶解使烧杯中液面上升,溶液进入漏斗,在重力作用下,溶液又会下落,如此反复;故答案为:c;漏斗中的液面忽上忽下;
转换率最大,故蒸氨的条件应选c。实验室用题图装置收集满氨气时,氨气溶解使烧杯中液面上升,溶液进入漏斗,在重力作用下,溶液又会下落,如此反复;故答案为:c;漏斗中的液面忽上忽下;
(4)蒸氨后过滤得到![]() ,加入盐酸酸化得到
,加入盐酸酸化得到![]() 溶液,向
溶液,向![]() 溶液中通入
溶液中通入![]() 制得CuCl,
制得CuCl,![]() 被还原成CuCl,则
被还原成CuCl,则![]() 被氧化成
被氧化成![]() ,根据得失电子守恒、原子守恒配平化学方程式为
,根据得失电子守恒、原子守恒配平化学方程式为![]() ,故反应Ⅱ的离子方程式为
,故反应Ⅱ的离子方程式为![]() ;故答案为:
;故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列描述正确的是
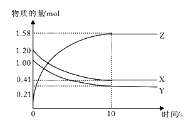
A.反应开始到10s,用Z表示的平均反应速率为0.158 mol/(L·s)
B.反应开始到10s,X的物质的量浓度减少了0.79 mol/L
C.反应的化学方程式为:X(g)+Y(g)![]() Z(g)
Z(g)
D.反应开始到10s时,Y的转化率为79.0%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究学习小组要制备一种在水中溶解度很小的黄色化合物![]() ,并用滴定法测定其组成。已知
,并用滴定法测定其组成。已知![]() 在温度高于
在温度高于![]() 时易发生分解。实验操作如下:
时易发生分解。实验操作如下:
步骤一:将图甲分液漏斗中的草酸溶液滴入锥形瓶内,可生成黄色沉淀;
步骤二:称取黄色产物![]() 于锥形瓶中,加入足量的硫酸并水浴加热至
于锥形瓶中,加入足量的硫酸并水浴加热至![]() 。待固体全部溶解后,用胶头滴管吸出一滴溶液点在点滴板上,用铁氰化钾溶液检验,无蓝色沉淀产生;
。待固体全部溶解后,用胶头滴管吸出一滴溶液点在点滴板上,用铁氰化钾溶液检验,无蓝色沉淀产生;
步骤三:用![]() 标准液滴定步骤二所得的溶液;
标准液滴定步骤二所得的溶液;
步骤四:向步骤三滴定后的溶液中加足量的Zn粉和硫酸溶液,几分钟后用胶头滴管吸出一滴点在点滴板上,用KSCN溶液检验,若不显红色,过滤除去Zn粉,并用稀硫酸洗涤Zn粉,将洗涤液与滤液合并,用![]() 标准液滴定,用去高锰酸钾标准液
标准液滴定,用去高锰酸钾标准液![]() 。
。

(1)步骤一中将沉淀从反应混合物中分离出来的操作名称是________。
(2)步骤二中水浴加热并控制温度![]() 的理由是________,加铁氰化钾溶液无蓝色沉淀产生,此操作的目的是________。
的理由是________,加铁氰化钾溶液无蓝色沉淀产生,此操作的目的是________。
(3)步骤三盛装![]() 标准液的滴定管在滴定前后的液面如图乙所示,则消耗
标准液的滴定管在滴定前后的液面如图乙所示,则消耗![]() 标准液的体积为________,该滴定管为________滴定管
标准液的体积为________,该滴定管为________滴定管![]() 填“酸式”或“碱式”
填“酸式”或“碱式”![]() 。
。
(4)步骤四中滴定时发生反的离子方程式为________。若不合并洗涤液,则消耗![]() 标准液的体积将________
标准液的体积将________![]() 填“增大”“减小”或“不变”
填“增大”“减小”或“不变”![]() 。由以上数据计算黄色化合物的化学式为________。
。由以上数据计算黄色化合物的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向容积均为0.5L的甲、乙、丙三个密闭容器中分别充入一定量的A和B,发生反应:A(g)+xB(g)![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如图表所示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如图表所示:
容器 | 甲 | 乙 | 丙 |
温度/℃ | T1 | T2 | T2 |
反应物起始量 | 1.5molA 0.5molB | 1.5molA 0.5molB | 3.0molA 1.0molB |
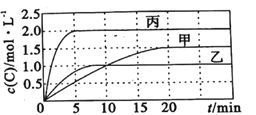
则: (1)该反应为____________(填 “放热反应”或“吸热反应”)
(2)丙容器中前5分钟的A的反应速率为__________
(3)该可逆反应达到平衡后,为在提高反应速率的同时提高B的转化率,可采取的措施有___________(填标号)。
a.按体积比1:1再充入A和B b.改用高效催化剂 c.升高温度 d.增加A的浓度 e. 增加C的浓度
(4)乙容器中的化学平衡常数为_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两上实验:(N2O4![]() 2NO2 △H> 0)
2NO2 △H> 0)
(a)将两容器置于沸水中加热
(b)在活塞上都加2 kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,正确的是
A.(a)甲>乙,(b)甲>乙B.(a)甲>乙,(b)甲=乙
C.(a)甲>乙,(b)甲<乙D.(a)甲<乙,(b)甲>乙==
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,硫酸既表现了氧化性又表现了酸性的是( )
A.2H2SO4(浓)+Cu![]() CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
B.2H2SO4(浓)+C![]() CO2↑+2H2O+2SO2↑
CO2↑+2H2O+2SO2↑
C.H2SO4(浓)+NaNO3![]() NaHSO4+HNO3↑
NaHSO4+HNO3↑
D.H2SO4+Na2SO3===Na2SO4+H2O+SO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
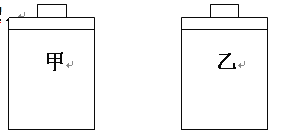
【题目】为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学们分别设计了如图甲、乙所示的实验装置。请回答相关问题:
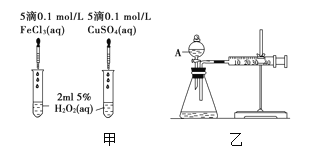
(1)定性如图甲可通过观察_________定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是_________。写出H2O2在二氧化锰作用下发生反应的化学方程式____。
(2)定量如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验因素均已忽略。检查该装置气密性的方法是__________________。图中仪器A名称为________,实验中需要测量的数据是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锰是一种植物合成叶绿素的催化剂,也可用于制备多种含锰物质。
回答下列问题:
⑴工业上可用惰性电极电解MnSO4溶液的方法制备MnO2,其阳极的电极反应式为________。
⑵我国普遍采用两矿加酸法制备MnSO4。两矿指软锰矿(主要成分MnO2,含少量Al2O3和SiO2)、黄铁矿(FeS2)。生产MnSO4的工艺流程如下:
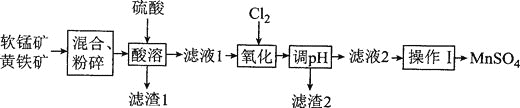
①软锰矿和黄铁矿需按一定比例混合,若黄铁矿过量太多,将导致的主要后果为________。
②“酸溶”时,黄铁矿被氧化为Fe3+、SO42-的离子方程式为________,该操作需控制在90℃,温度不能过低的原因为________。
③若使“氧化”的溶液中杂质离子除净,“调pH”应不小于________![]() 保留两位有效数字
保留两位有效数字![]() 。已知:Mn(OH)2、Al(OH)3、Fe(OH)3的Ksp分别为2.0×10-13、1.0×10-33、4.0×10-38,溶液中离子浓度小于等于10-5 mol·L-1时,认为该离子沉淀完全。
。已知:Mn(OH)2、Al(OH)3、Fe(OH)3的Ksp分别为2.0×10-13、1.0×10-33、4.0×10-38,溶液中离子浓度小于等于10-5 mol·L-1时,认为该离子沉淀完全。
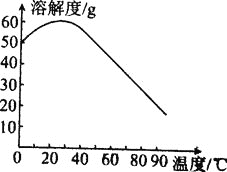
④MnSO4的溶解度曲线如图所示,则“操作I”,为________、________、用热水洗涤、干燥。
⑶用(NH4)2S2O8溶液鉴别溶液中Mn2+的现象为溶液变为紫红色。所发生反应中氧化剂和还原剂的物质的量之比为________。S2O82-中含有1个过氧键。则其中S元素的化合价为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应![]() 在容积为10L的密闭容器中进行。起始时
在容积为10L的密闭容器中进行。起始时![]() 和
和![]() 均为0.20mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。下列说法不正确的是( )
均为0.20mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。下列说法不正确的是( )

A. 实验c条件下,从反应开始至达到平衡时![]()
B. 实验a条件下,用浓度表示的平衡常数为100
C. 该反应的![]()
D. 比较实验a、c可判断升高温度反应速率加快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com