
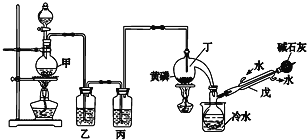
【题目】如图是某化学兴趣小组制备PCl3的实验装置(部分仪器已省略):
有关物质的部分性质如下:
熔点/℃ | 沸点/℃ | 其他 | |
黄磷 | 44.1 | 280.5 | 2P(过量)+3Cl2 |
PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl,能溶于PCl3 |
请回答下列问题:
(1)仪器戊的名称为___。
(2)实验时甲中所发生反应的化学方程式为___。
(3)乙中盛放的试剂是___,其作用是___;丙中盛放的试剂是___,其作用是___。
(4)向仪器丁中通入干燥、纯净的Cl2之前,应先通入一段时间的CO2,其目的主要是___。
(5)碱石灰的作用是___(答出一条即可)。
(6)PCl3粗产品中常含有POCl3、PCl5等,加入黄磷(化学式用P表示)经加热除去PCl5的化学反应方程式为___,后通过___(填实验操作名称),即可得到PCl3纯品。
【答案】冷凝管 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 饱和氯化钠溶液 除去氯气中的氯化氢 浓硫酸 除去氯气中的水蒸气 排净装置中的空气,防止空气中的水分和氧气与PCl3反应 吸收多余的Cl2,防止污染环境;防止空气中的水蒸气进入影响产品纯度; 3PCl5+2P
MnCl2+Cl2↑+2H2O 饱和氯化钠溶液 除去氯气中的氯化氢 浓硫酸 除去氯气中的水蒸气 排净装置中的空气,防止空气中的水分和氧气与PCl3反应 吸收多余的Cl2,防止污染环境;防止空气中的水蒸气进入影响产品纯度; 3PCl5+2P![]() 5PCl3 蒸馏
5PCl3 蒸馏
【解析】
甲装置中为浓盐酸与二氧化锰反应生成氯气,氯气中含有的杂质为HCl、水蒸气,分别用饱和食盐水和浓硫酸除去,纯净的氯气与黄磷在加热条件下反应生成气态的![]() ,冷却得到液态的
,冷却得到液态的![]() 。
。
![]() 根据装置图可知仪器戊名称为冷凝管;
根据装置图可知仪器戊名称为冷凝管;
![]() 装置甲中二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水,反应的化学方程式为
装置甲中二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水,反应的化学方程式为![]() 浓)
浓)![]() ;
;
![]() 氯气中含有的杂质为HCl、水蒸气,分别用饱和食盐水和浓硫酸除去,所以乙中盛放的试剂是饱和氯化钠溶液用于除去氯气中的氯化氢,丙中盛放的试剂是浓硫酸用于除去水蒸气;
氯气中含有的杂质为HCl、水蒸气,分别用饱和食盐水和浓硫酸除去,所以乙中盛放的试剂是饱和氯化钠溶液用于除去氯气中的氯化氢,丙中盛放的试剂是浓硫酸用于除去水蒸气;
![]() 由于
由于![]() 遇
遇![]() 会生成
会生成![]() ,遇水生成
,遇水生成![]() 和HCl,通入一段时间的
和HCl,通入一段时间的![]() 可以排尽装置中的空气,防止生成的
可以排尽装置中的空气,防止生成的![]() 与空气中的
与空气中的![]() 和水反应;所以通入二氧化碳赶净空气,避免水和氧气与三氯化磷发生反应;
和水反应;所以通入二氧化碳赶净空气,避免水和氧气与三氯化磷发生反应;
![]() 氯气有毒,污染空气,碱石灰吸收多余氯气防止污染空气;防止空气中的水蒸气进入影响产品纯度;
氯气有毒,污染空气,碱石灰吸收多余氯气防止污染空气;防止空气中的水蒸气进入影响产品纯度;
![]() 在加热条件下,黄磷与
在加热条件下,黄磷与![]() 反应生成
反应生成![]() ,则反应的方程式为:3PCl5+2P
,则反应的方程式为:3PCl5+2P![]() 5PCl3;
5PCl3;![]() 沸点较低,加热易挥发,可以利用蒸馏的方法分离出三氯化磷。
沸点较低,加热易挥发,可以利用蒸馏的方法分离出三氯化磷。


科目:高中化学 来源: 题型:
【题目】如图为我国圆明园兽首铜像—兔首和鼠首,看上去仍熠熠生辉。下列对其原因的分析最可能的是( )

A.它们表面的铜绿已用酸性溶液洗去B.利用电镀原理在其表面镀了一层耐腐蚀的黄金
C.铜的活动性很弱,与空气成分不反应D.它们是含一定比例金、银、锡、锌的铜合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】传统的定量化学实验受到计量手段的制约而研究范围狭窄、精确度不高,DIS数字化信息系统(由传感器、数据采集器和计算机组成)因为可以准确测量溶液的pH等而在中和滴定的研究中应用越来越广泛深入。
(1)某学习小组利用 DIS 系统探究强碱和不同酸的中和反应,实验过程如下:
①分别配制0.1000 mol/L的NaOH、HCl、CH3COOH溶液备用。
②用0.1000 mol/L的NaOH溶液分别滴定10.00 mL 0.1000 mol/L的HCl和CH3COOH溶液,连接数据采集器和pH传感器。
③由计算机绘制的滴定曲线如图:
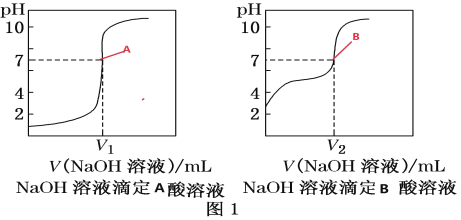
(2)①A是_____酸(填“醋酸”或“盐酸”)
②两曲线图中 V1________V2(填“>”“=”或“<”),A点和B点,水的电离程度_____(填“A 点大”、“B 点大”、“A 和 B 点相同”或“无法判断”)
(3)另一个学习小组利用DIS系统测定某醋酸溶液的物质的量浓度,以测量溶液导电能力来判断滴定终点,实验步骤如下:
①用________(填仪器名称)量取 20.00 mL 醋酸溶液样品,倒入洁净干燥锥形瓶中,连接好 DIS系统,如果锥形瓶中含有少量蒸馏水,是否会影响测量结果?______(填“是”“否”或“不能确定”)。向锥形瓶中滴加 0.1000 mol/L的NaOH溶液,计算机屏幕上显示溶液导电能力与加入NaOH溶液体积关系的曲线图(见如图)。
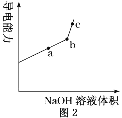
②醋酸与NaOH溶液反应的离子方程式为______。
③图中b点时,溶液中各离子浓度大小的关系是_________,c(CH3COOH)+c(CH3COO-)=_________mol/L。
④若图中某一点 pH 等于8,则 c(Na+)-c(CH3COO-)的精确值为________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生产或实验事实引出的结论不正确的是( )
选项 | 事实 | 结论 |
A | 其他条件相同, | 当其他条件不变时,升高反应温度,化学反应速率加快 |
B | 工业制硫酸过程中,在 | 增大气液接触面积,使 |
C | 在2L密闭容器中发生反应:
| 反应速率减慢 |
D | A、B两支试管中分别加入等体积5%的 | 当其他条件不变时,催化剂可以改变化学反应速率 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应的快慢和限度对人类生产生活有重要的影响。800℃时,A、B、C三种气体在恒容密闭容器中反应时的浓度变化如图所示,回答下列问题:

(1)该反应的生成物是________。
(2)2min内,C的反应速率为________。
(3)该反应的化学方程式为________。
(4)在其他条件下,测得A的反应速率为![]() ,此时的反应速率与800℃时相比_____。
,此时的反应速率与800℃时相比_____。
A.比800℃时慢 B.比800℃时快 C.和800℃时速率一样
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组欲测定KClO3,溶液与![]() 溶液反应的化学反应速率.所用试剂为10mL0.1mol/LKClO3,溶液和
溶液反应的化学反应速率.所用试剂为10mL0.1mol/LKClO3,溶液和![]() 溶液,所得数据如图所示。已知:
溶液,所得数据如图所示。已知:![]() 。
。
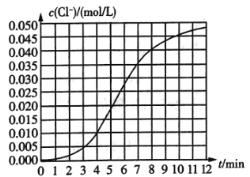
(1)根据实验数据可知,该反应在0~4min内的平均反应速率![]() ________
________![]() 。
。
(2)某同学仔细分析实验数据后发现,在反应过程中,该反应的化学反应速率先增大后减小.某小组同学针对这一现象进一步探究影响该化学反应速率的因素,具体方法如表示。
方案 | 假设 | 实验操作 |
Ⅰ | 该反应放热使溶液温度升高,反应速率加快 | 向烧杯中加入10mL0.1mo//L的 |
Ⅱ | 取10mL0.1mo/L的 | |
Ⅲ | 溶液酸性增强加快了化学反应速率 | 分别向a、b两只烧杯中加入10mL0.1mol/L的 |
①补全方案Ⅰ中的实验操作:________。
②方案Ⅱ中的假设为________。
③除Ⅰ、Ⅱ、Ⅲ中的假设外,还可以提出的假设是________。
④某同学从控制变量的角度思考,认为方案Ⅲ中实验操作设计不严谨,请进行改进:________。
⑤反应后期,化学反应速率变慢的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、Co、Ni均为第Ⅷ族元素,它们的化合物在生产生活中有着广泛的应用。
(1)基态Ni原子价电子中成对电子数与未成对电子数之比为_________。
(2)MgO与CaO这两个物质,其中熔点较高的是______,原因是___________________________________________。
(3)第二周期中,第一电离能介于B元素和N元素之间的元素有_________种。
(4)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯的聚合, 其结构如图所示。
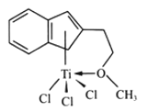
①组成M的元素中,电负性最大的是__________ (填名称)。
②M中碳原子的杂化方式为__________。
③M中不含__________ (填代号)。
a、π键 b、σ键 c、离子键 d、配位键
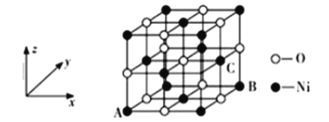
(5)NiO的晶体结构如图所示,其中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X是一种重要的有机合成中间体,用于制造塑料、涂料和黏合剂等高聚物。为研究X的组成与结构,进行了如下实验:
(1)有机物X的质谱图:
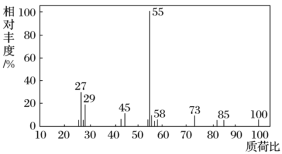
有机物X的相对分子质量是__________。
(2)将10.0 g X在足量O2中充分燃烧,并使其产物依次通过足量的无水CaCl2和KOH浓溶液,发现无水CaCl2增重7.2 g,KOH浓溶液增重22.0 g。有机物X的分子式是________________。
(3)经红外光谱测定,有机物X中含有醛基;有机物X的核磁共振氢谱图上有2个吸收峰,峰面积之比是3∶1。有机物X的结构简式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的数值,下列叙述中正确的是
A.常温常压下,11.2 LNH3所含的原子数为2NA
B.标准状况下,22.4 LCl2所含的原子数为NA
C.常温常压下,80 gSO3所含的氧原子数为3NA
D.一定条件下,56 g铁与足量HNO3完全反应,转移电子数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com