
【题目】传统的定量化学实验受到计量手段的制约而研究范围狭窄、精确度不高,DIS数字化信息系统(由传感器、数据采集器和计算机组成)因为可以准确测量溶液的pH等而在中和滴定的研究中应用越来越广泛深入。
(1)某学习小组利用 DIS 系统探究强碱和不同酸的中和反应,实验过程如下:
①分别配制0.1000 mol/L的NaOH、HCl、CH3COOH溶液备用。
②用0.1000 mol/L的NaOH溶液分别滴定10.00 mL 0.1000 mol/L的HCl和CH3COOH溶液,连接数据采集器和pH传感器。
③由计算机绘制的滴定曲线如图:
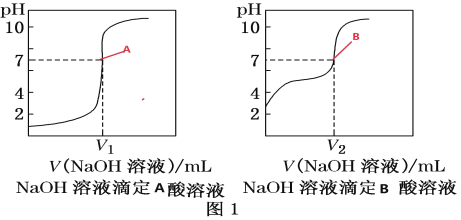
(2)①A是_____酸(填“醋酸”或“盐酸”)
②两曲线图中 V1________V2(填“>”“=”或“<”),A点和B点,水的电离程度_____(填“A 点大”、“B 点大”、“A 和 B 点相同”或“无法判断”)
(3)另一个学习小组利用DIS系统测定某醋酸溶液的物质的量浓度,以测量溶液导电能力来判断滴定终点,实验步骤如下:
①用________(填仪器名称)量取 20.00 mL 醋酸溶液样品,倒入洁净干燥锥形瓶中,连接好 DIS系统,如果锥形瓶中含有少量蒸馏水,是否会影响测量结果?______(填“是”“否”或“不能确定”)。向锥形瓶中滴加 0.1000 mol/L的NaOH溶液,计算机屏幕上显示溶液导电能力与加入NaOH溶液体积关系的曲线图(见如图)。
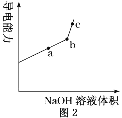
②醋酸与NaOH溶液反应的离子方程式为______。
③图中b点时,溶液中各离子浓度大小的关系是_________,c(CH3COOH)+c(CH3COO-)=_________mol/L。
④若图中某一点 pH 等于8,则 c(Na+)-c(CH3COO-)的精确值为________mol/L。
【答案】盐酸 > A和B点相同 酸式滴定管 否 CH3COOH+OH-=CH3COO-+H2O c(Na+)>c(CH3COO-)>c(OH-)>c(H+) 0.05mol/L 9.9×10-7
【解析】
(1)根据盐酸是强酸,完全电离,CH3COOH是弱酸,部分电离;根据生成的盐是否发生水解来判断;
(3)①根据量取醋酸溶液的体积精确度来解答;根据c(待测)=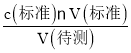 分析误差;
分析误差;
②根据醋酸与NaOH溶液反应生成盐和水书写方程式;
③图中b点,说明醋酸和NaOH恰好完全反应,根据盐类水解来判断离子浓度,根据物料守恒计算c(CH3COOH)+c(CH3COO-);
④先求出溶液中的c(H+)和c(OH-),再根据电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-)来解答。
(2)CH3COOH是弱酸,在溶液中存在电离平衡,主要以电解质分子形式存在,不能完全电离,而HCl完全电离,这样会使等浓度的CH3COOH溶液中c(H+)比同浓度的HCl溶液中c(H+)小,溶液pH大;0.1000 mol/L酸溶液pH=1,说明c(H+)=0.1000mol/L,所以A表示的是盐酸;
V1时盐酸和NaOH反应生成氯化钠和水,氯化钠不水解;CH3COOH和NaOH反应生成醋酸钠和水,醋酸钠水解是溶液呈碱性,V2时溶液呈中性,要使溶液的pH=7,醋酸未完全反应,此时溶液为CH3COONa和CH3COOH的混合溶液,所以消耗的NaOH前者大于后者;
A点为NaCl溶液,该盐是强酸强碱盐,不水解,对水的电离平衡无影响;后者为CH3COOH和CH3COONa的混合溶液,CH3COOH电离产生H+抑制水的电离,而CH3COO-水解消耗水电离产生的H+产生CH3COOH,促进水的电离作用,由于溶液的pH=7,说明CH3COOH电离随水电离的抑制作用与CH3COO-水解对水电离的促进作用相同,二者相互抵消,因此对水电离平衡无影响,故A点和B点的水的电离程度相同;
(3)①用酸式滴定管量取20.00mL醋酸溶液样品;锥形瓶中含有少蒸馏水,待测液的物质的量不变,V(标准)不变,根据c(待测)=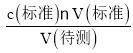 ,c(待测)不变,不产生任何影响;
,c(待测)不变,不产生任何影响;
②醋酸与NaOH溶液反应:CH3COOH+NaOH=CH3COONa+H2O,反应的离子方程式为CH3COOH+OH-=CH3COO-+H2O;
③图中b点,醋酸和NaOH恰好完全反应产生醋酸钠,醋酸钠是强碱弱酸盐,在溶液中发生电离:CH3COONa=CH3COO-+Na+,电离产生的CH3COO-发生水解而消耗,使得c(Na+)>c(CH3COO-),CH3COO-水解消耗水电离产生的H+,最终达到平衡时,溶液中c(OH-)>c(H+),使溶液显碱性,但水电离程度非常微弱,盐电离产生的离子浓度大于水电离产生的离子浓度,所以溶液中离子浓度大小关系为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);根据物料守恒可得c(Na+)=c(CH3COOH)+c(CH3COO-)= ![]() =0.05mol/L;
=0.05mol/L;
④溶液的pH=8,则c(H+)=10-8 mol/L,根据室温下水的离子积常数Kw=1×10-14可知 c(OH-)=![]() mol/L=10-6mol/L,根据电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-),c(Na+)-c(CH3COO-)=c(OH-)-c(H+)=10-6mol/L-10-8mol/L=9.9×10-7mol/L。
mol/L=10-6mol/L,根据电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-),c(Na+)-c(CH3COO-)=c(OH-)-c(H+)=10-6mol/L-10-8mol/L=9.9×10-7mol/L。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列叙述中错误的是( )
A.熔融状态下NaHSO4电离方程式为:NaHSO4(熔融)=Na++HSO![]() 。
。
B.强电解质的水溶液中无溶质分子,弱电解质的水溶液中有溶质分子
C.1 mol·L-1的醋酸溶液中c(H+)=0.01 mol·L-1可以证明醋酸是弱电解质
D.HF、HCl、BaSO4都是强电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pOH=-lgc(OH-)。室温下,将稀盐酸滴加到某一元碱(BOH)溶液中,测得混合溶液的pOH与离子浓度的变化关系如图所示。下列叙述错误的是

A. BOH属于弱碱
B. BOH的电离常数K=1×10-4.8
C. P点所示的溶液中:c(Cl-)>c(B+)
D. N点所示的溶液中:c(H+)=c(Cl-)+c(OH-)-c(BOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属和非金属被广泛应用于人类生产生活中。
(1)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用含有小苏打的药品以中和过多的胃酸,其反应的离子方程式:___________________________;
(2)中华透明牙膏摩擦剂SiO2是工业制备晶体硅的原料,工业上制粗硅的反应原理是 __________;(用化学反应方程式表示)。
(3)硅酸钠的水溶液俗称水玻璃,向其中通入过量的CO2,会出现胶状沉淀,其离子方程式是_________;
(4)人体血红蛋白中含有Fe2+,若误食亚硝酸盐,会导致Fe2+转化Fe3+而中毒,服用维生素C可以解毒.对上述的分析正确的是(______)
A.亚硝酸盐是还原剂 B.维生素C是氧化剂
C.维生素C被氧化 D.亚硝酸盐发生氧化反应
(5)化学与生产、生活、社会等密切相关,下列说法正确的是(_______)
A. 二氧化硫具有漂白性,可用来增白纸浆、草帽辫、食品等
B. 酸雨是空气中二氧化碳含量超标引起的
C.工业上合成氨气可用浓氨水和生石灰混合制得
D.蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性
E.洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一,漂白粉是常用的消毒剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnSO4晶体是一种易溶于水的微红色晶体,某校同学设计实验制备并检验MnSO4的性质。回答下列问题:
(1)甲组同学设计用SO2和适量纯净的MnO2制备MnSO4,其装置如下:
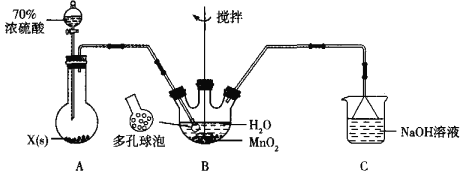
①A装置中固体药品X通常是______填化学式)。
②B装置中通SO2的导管末端接多孔球泡的目的是______;C装置用于吸收少量的SO2,发生反应的离子方程式为______。
(2)乙组同学定性检验甲组同学的产品中Mn2+的存在,取少量晶体溶于水,加入(NH4)2S2O8溶液,滴入硝酸银(作催化剂),微热振荡,溶液显紫色,发生反应的离子方程式为______。
(3)丙组同学为检验无水MnSO4(接近白色)的热分解产物,将MnSO4晶体脱水后放入下图所示的装置中,打开K1和K2,缓慢通入N2,加热,硬质玻璃管中最后得到黑色固体。
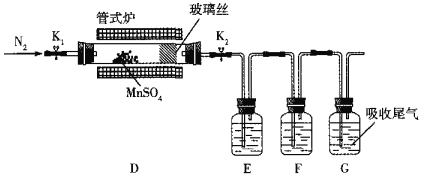
①检验分解的气态产物中是否有SO2及SO3,装置E、F中的溶液依次是______、______(填字母)。
a.Ba(NO3)2溶液b.BaCl2溶液c.品红溶液d.浓硫酸
②若D中得到的黑色粉末为Mn3O4,E、F中均有明显现象,则D中发生反应的化学方程式为______。
(4)丁组同学设计实验以丙组同学得到的黑色粉末为原料,利用铝热反应原理将其还原为金属锰,所需的药品除氯酸钾外,还需要______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相对分子质量为92的某芳香烃X是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO。
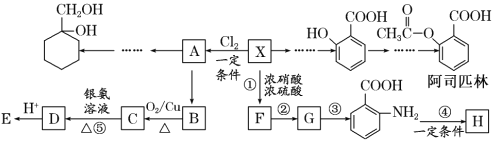
已知:Ⅰ.![]()
Ⅱ.![]() (苯胺,易被氧化)
(苯胺,易被氧化)
请根据所学知识与本题所给信息回答下列问题:
(1)X→A的反应条件是____。
(2)H的结构简式是____。
(3)反应③④的类型是____、____。
(4)反应⑤的化学方程式是____。
(5)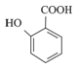 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有___种。
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有___种。
(6)请用合成反应流程图表示出由![]() 和其他无机物合成
和其他无机物合成![]() 的最合理的方案(不超过4步)__________。
的最合理的方案(不超过4步)__________。
例如:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.无色溶液:NH![]() 、Cu2+、NO
、Cu2+、NO![]() 、SO
、SO![]()
B.能使紫色石蕊试液变红的溶液:Al3+、Fe3+、NO![]() 、Cl-
、Cl-
C.滴加KSCN溶液显红色的溶液:Ba2+、K+、Cl-、OH-
D.与铝反应产生大量氢气的溶液:Na+、Mg2+、CO![]() 、NO
、NO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某化学兴趣小组制备PCl3的实验装置(部分仪器已省略):
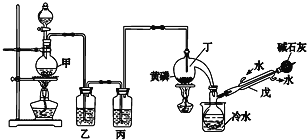
有关物质的部分性质如下:
熔点/℃ | 沸点/℃ | 其他 | |
黄磷 | 44.1 | 280.5 | 2P(过量)+3Cl2 |
PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl,能溶于PCl3 |
请回答下列问题:
(1)仪器戊的名称为___。
(2)实验时甲中所发生反应的化学方程式为___。
(3)乙中盛放的试剂是___,其作用是___;丙中盛放的试剂是___,其作用是___。
(4)向仪器丁中通入干燥、纯净的Cl2之前,应先通入一段时间的CO2,其目的主要是___。
(5)碱石灰的作用是___(答出一条即可)。
(6)PCl3粗产品中常含有POCl3、PCl5等,加入黄磷(化学式用P表示)经加热除去PCl5的化学反应方程式为___,后通过___(填实验操作名称),即可得到PCl3纯品。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工原料异丁烯(C4H8)可由异丁烷(C4H10)直接催化脱氢制备:C4H10(g) ![]() C4H8(g) + H2(g)ΔH=+139 kJ/mol
C4H8(g) + H2(g)ΔH=+139 kJ/mol
(1)该反应的化学平衡常数的表达式为_________________。
(2)一定条件下,以异丁烷为原料生产异丁烯。温度、压强改变对异丁烷平衡转化率的
影响如下图所示。
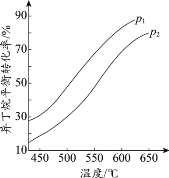
①判断p1、p2的大小关系:p1_________________(填“>”或“<”)p2,理由是_________________。
②若异丁烷的平衡转化率为40%,则平衡混合气中异丁烯的物质的量分数最多为______%(保留小数点后1位)。
(3)目前,异丁烷催化脱氢制备异丁烯的研究热点是催化活性组分以及载体的选择。下表是以V-Fe-K-O为催化活性物质,反应时间相同时,测得的不同温度、不同载体条件下的数据。
温度/℃ | 570 | 580 | 590 | 600 | 610 | |
以γ-Al2O3为载体 | 异丁烷转化率/% | 36.41 | 36.49 | 38.42 | 39.23 | 42.48 |
异丁烯收率/% | 26.17 | 27.11 | 27.51 | 26.56 | 26.22 | |
以TiO2为载体 | 异丁烷转化率/% | 30.23 | 30.87 | 32.23 | 33.63 | 33.92 |
异丁烯收率/% | 25.88 | 27.39 | 28.23 | 28.81 | 29.30 | |
说明:收率=(生产目标产物的原料量/原料的进料量)×100%
①由上表数据,可以得到的结论是____________(填字母序号)。
a.载体会影响催化剂的活性
b. 载体会影响催化剂的选择性
c.载体会影响化学平衡常数
②分析以γ-Al2O3为载体时异丁烯收率随温度变化的可能原因:___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com